题目内容
18.已知常温下,BaSO4的Ksp为1×10-10.现将0.01mol/L Ba(OH)2溶液与0.02mol/L的Na2SO4溶液等体积混合,充分反应.计算:(1)混合溶液中Ba2+物质的量浓度;
(2)混合溶液的pH值.
分析 (1)设出混合液的体积为1L,根据n=cV计算出氢氧化钡、硫酸钠的物质的量,根据反应判断过量,然后计算出反应后溶液中硫酸根离子浓度,再结合硫酸钡的溶度积计算出溶液中钡离子浓度;
(2)混合液中氢氧根离子不反应,计算出混合液中氢氧根离子浓度,再计算出氢离子浓度,最后得出溶液的pH.
解答 解:(1)设两溶液各取1L,氢氧化钡的物质的量为:0.01mol/L×1L=0.01mol,硫酸钠的物质的量为:0.02mol/L×1L=0.02mol,
Ba(OH)2+Na2SO4=BaSO4↓+2NaOH
1 mol 1 mol
0.01mol 0.02 mol
由以上数据可知Na2SO4剩余:n(Na2SO4)=0.02mol-0.01mol=0.01 mol,反应后溶液中硫酸根离子浓度为:c(SO42-)=$\frac{0.01mol}{2L}$=0.005mol/L,
则:c(Ba2+)=$\frac{1×1{0}^{-10}}{0.005}$=2×10-8 mol•L-1,
答:混合溶液中Ba2+物质的量浓度为2×10-8 mol•L-1.
(2)由以上反应可知OH-未参与离子反应,混合液中氢氧根离子浓度为:c(OH-)=$\frac{0.01mol×2}{2L}$=0.01mol/L,
c则c(H+)=$\frac{1×1{0}^{-14}}{0.01}$=1×10-12 mol•L-1,
混合液的pH=-lg 1×10-12=12,
答:反应后的混合液的pH为12.
点评 本题考查了难溶物溶度积的计算、溶液pH的计算,题目难度中等,注意掌握难溶物溶解平衡及溶度积的计算方法,明确溶液酸碱性与溶液pH的关系,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列说法正确的是( )
| A. | 乙烯的结构简式可表示为CH2CH2 | |
| B. | 苯、乙醇、乙酸都能发生取代反应 | |
| C. | 甲烷可以与氯气反应,而乙烯不能与氯气反应 | |
| D. | 液化石油气和天然气的主要成分都是甲烷 |
9.糖类、油脂和蛋白质是生命活动所必需的营养物质.下列叙述正确的是( )
| A. | 蛋白质遇浓硫酸变为黄色 | B. | 蔗糖水解产物仅有葡萄糖 | ||
| C. | 纤维素不能水解成葡萄糖 | D. | 油脂水解产物之一是甘油 |
6.如图1和图2是A、B两种物质的核磁共振氢谱.请根据图1和图2两种物质的核磁共振氢谱谱图选择出可能属于图1和图2的两种物质的分子式( )
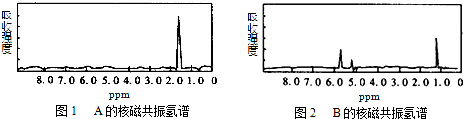

| A. | A是C3H6、B是C2H6 | B. | A是C6H6、B是C4H6 | C. | A是C6H6、B是C2H6 | D. | A是C3H8、B是C6H6 |
3.将2.56gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体(NOx)的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为( )
| A. | 0.05mol | B. | 0.13mol | C. | 1.05mol | D. | 1mol |
10.A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍.B在D中充分燃烧能生成其最高价化合物BD2.E+与D2-具有相同的电子数.A在F中燃烧,产物溶于水得到一种强酸.
回答下列问题:
(1)A在周期表中的位置是第一周期IA族,写出实验室制备单质F的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为纯碱.
(3)由这些元素组成的物质,其组成和结构信息如下表:
a的化学式为NaH;b的化学式为Na2O2和Na2C2;c的电子式为 .
.
回答下列问题:
(1)A在周期表中的位置是第一周期IA族,写出实验室制备单质F的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为纯碱.
(3)由这些元素组成的物质,其组成和结构信息如下表:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有共价键的二元离子化合物,且原子数之比为1:1 |
| c | 化学组成为ADF |
 .
.
4.食品安全、资源充分利用、保护环境备受关注,下列做法与此理念相违背的是( )
| A. | 食品中大量添加苯甲酸钠等防腐剂,可有效延长其保质期 | |
| B. | “地沟油”可以制成生物柴油,提高资源的利用率 | |
| C. | 发展光伏发电等高效清洁能源,缓解能源危机 | |
| D. | 大力发展公共交通,提高汽油的质量,对减轻雾霾很有必要 |
5.在研究物质变化时,不但要着眼于物质种类的变化,也要关注物质状态的变化.

(1)高温下水分解体系中主要物质的体积分数与温度的关系如图1所示.下列说法正确的是C
A.图中A、B表示的粒子依次是O和H
B.图中A、B表示的粒子依次是H+和O2-
C.图中A、B重新生成水时的活化能等于0
D.图中A、B重新生成水时的活化能大于0
(2)已知H2的燃烧热△H=-285.8kJ/mol,且H2O的汽化热为44.0kJ/mol.试写出H2燃烧生成水蒸气的热化学方程式H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol.
(3)在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图2,据图回答下列问题:
①从反应开始到第一次达到平衡时,用A物质表示的平均反应速率为0.067 mol/(L•min)(保留2位有效数字)
②第5min时,升高温度,A、B、D的物质的量变化如图,则该反应为吸热(填“吸热”或“放热”)反应.
③若在第7min时增加D的物质的量,其他条件不变,则A的物质的量图象变化正确的是b(用图中a、b、c的编号回答)
(4)在100℃、200KPa的条件下,反应aA(g)?bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下,逐步增大体系的压强(维持温度不变),如表列出的是不同压强下反应建立平衡时物质B的浓度.根据表中的数据,回答下列问题:
①比较大小:a= b+c(填“>”、“<”或“=”)
②压强从500KPa增加到1000KPa时,平衡正向移动(填“正向”、“逆向”或“不移动”),其原因可能为压强增大为原来的两倍,B浓度的变化大于两倍,说明C在增大压强时变为非气体,平衡正向移动.

(1)高温下水分解体系中主要物质的体积分数与温度的关系如图1所示.下列说法正确的是C
A.图中A、B表示的粒子依次是O和H
B.图中A、B表示的粒子依次是H+和O2-
C.图中A、B重新生成水时的活化能等于0
D.图中A、B重新生成水时的活化能大于0
(2)已知H2的燃烧热△H=-285.8kJ/mol,且H2O的汽化热为44.0kJ/mol.试写出H2燃烧生成水蒸气的热化学方程式H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol.
(3)在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图2,据图回答下列问题:
①从反应开始到第一次达到平衡时,用A物质表示的平均反应速率为0.067 mol/(L•min)(保留2位有效数字)
②第5min时,升高温度,A、B、D的物质的量变化如图,则该反应为吸热(填“吸热”或“放热”)反应.
③若在第7min时增加D的物质的量,其他条件不变,则A的物质的量图象变化正确的是b(用图中a、b、c的编号回答)
(4)在100℃、200KPa的条件下,反应aA(g)?bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下,逐步增大体系的压强(维持温度不变),如表列出的是不同压强下反应建立平衡时物质B的浓度.根据表中的数据,回答下列问题:
| 压强(KPa) | 200 | 500 | 1000 |
| B的浓度(mol/L) | 0.04 | 0.1 | 0.27 |
②压强从500KPa增加到1000KPa时,平衡正向移动(填“正向”、“逆向”或“不移动”),其原因可能为压强增大为原来的两倍,B浓度的变化大于两倍,说明C在增大压强时变为非气体,平衡正向移动.
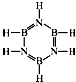 已知化合物B3N3H6(硼氮苯)与C6H6(苯)为等电子体,分子结构如图.则硼氮苯的四氯取代物B3N3H2Cl4的同分异构体的数目为( )
已知化合物B3N3H6(硼氮苯)与C6H6(苯)为等电子体,分子结构如图.则硼氮苯的四氯取代物B3N3H2Cl4的同分异构体的数目为( )