题目内容
将7.28gFe溶于过量的稀H2SO4中,在加热的条件下,用2.02gKNO3去氧化溶液中Fe2+,待反应完全后,剩余Fe2+还需0.4mol/LKMnO4溶液25mL才能完全氧化,已知其反应方程式为:5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O。则KNO3的还原产物是
| A.N2O | B.NO | C.NO2 | D.N2O3 |
A
试题分析:7.28gFe溶于过量的稀H2SO4中得到n(Fe2+)为0.13mol。加入KNO3和KMnO4后,NO3-和MnO4-将Fe2+氧化成Fe3+,设KNO3的还原产物中N的化合价为x,则失电子总数为0.13mol,得电子总数为
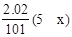 +0.4mol×0.025L×5=0.13,所以x=1,所以还原产物为N2O。答案选A。
+0.4mol×0.025L×5=0.13,所以x=1,所以还原产物为N2O。答案选A。点评:本题根据得失电子数相等计算简单。

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目
 Cu2S + 3CuSO4 + 4H2O的叙述正确的是
Cu2S + 3CuSO4 + 4H2O的叙述正确的是