题目内容
硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4=H++HSO4-,HSO4- H++SO42-.
H++SO42-.
请据此回答下列有关问题:
(1)Na2SO4溶液呈 (填“弱酸性”、“中性”或“弱碱性”),原因是: (用离子方程式表示)
(2)写出H2SO4溶液与BaCl2溶液反应的离子方程式: ;
(3)在0.1 mol·L-1的Na2SO4溶液中,下列粒子浓度关系式正确的是 。(填编号)
(4)已知0.1 mol·L-1的NaHSO4溶液的pH=2,则0.1 mol·L-1的H2SO4溶液中SO42-的浓度 0.01mol·L-1(填“>” “="”" 或“<”)。
 H++SO42-.
H++SO42-.请据此回答下列有关问题:
(1)Na2SO4溶液呈 (填“弱酸性”、“中性”或“弱碱性”),原因是: (用离子方程式表示)
(2)写出H2SO4溶液与BaCl2溶液反应的离子方程式: ;
(3)在0.1 mol·L-1的Na2SO4溶液中,下列粒子浓度关系式正确的是 。(填编号)
| A.c(SO42-)+c(HSO4-)=0.1 mol·L-1 | B.c(SO42-)+c(HSO4-)=2 c(Na+) |
| C.c(OH-)=c(H+)+c(HSO4-) | D.c(Na+)+c(H+)=c(OH-)+c(HSO4-) |
(1)弱碱性 ;SO42-+H2O  HSO4—+ OH—(2)HSO4-+Ba2+ = BaSO4↓+ H+
HSO4—+ OH—(2)HSO4-+Ba2+ = BaSO4↓+ H+
(3)AC (4)<
 HSO4—+ OH—(2)HSO4-+Ba2+ = BaSO4↓+ H+
HSO4—+ OH—(2)HSO4-+Ba2+ = BaSO4↓+ H+ (3)AC (4)<
试题分析:硫酸的第一步电离是完全的:H2SO4=H++HSO4-,第二步电离并不完全:HSO4-
 H++SO42-.(1)根据题给信息Na2SO4溶液存在SO42-的水解平衡:SO42-+H2O
H++SO42-.(1)根据题给信息Na2SO4溶液存在SO42-的水解平衡:SO42-+H2O OH-+HSO4-,溶液呈弱碱性;
OH-+HSO4-,溶液呈弱碱性;(2)硫酸溶液中存在HSO4-离子,难电离,硫酸与氯化钡溶液反应的离子方程式为:HSO4-+Ba2+=BaSO4↓+H+,
(3)0.lmol?L-1Na2SO4溶液中离子浓度关系:根据物料守恒,c( Na+)=2c(SO42-)+2c(HSO4-)=0.2mol?L-1,A项正确,B项错误;根据质子守恒:c(OH-)=c( HSO4-)+c(H+),C项正确;根据电荷守恒:c( Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-),C项错误;选AC;
(4)0.1 mol·L-1NaHSO4溶液的pH=2,根据电离方程式判断c(SO42-)=0.01mol?L-1,而0.1mol?L-1H2SO4溶液中氢离子浓度比硫酸氢钠溶液中大,对硫酸氢根离子的电离起抑制作用,所以c( SO42-)<0.01mol?L-1。

练习册系列答案
相关题目

 不变;⑤OH–数目增大,H+数目减小;⑥pH增大;⑦ c(H+)与c(OH–)的乘积减小
不变;⑤OH–数目增大,H+数目减小;⑥pH增大;⑦ c(H+)与c(OH–)的乘积减小 H+(无色)+In-(黄色),而被用作酸碱指示剂。往该溶液中加入足量Na2O2粉末,则溶液最终颜色为
H+(无色)+In-(黄色),而被用作酸碱指示剂。往该溶液中加入足量Na2O2粉末,则溶液最终颜色为 CH3COO-+H+,加少量烧碱溶液可使溶液中
CH3COO-+H+,加少量烧碱溶液可使溶液中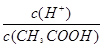 值增大。
值增大。