题目内容
【题目】下列叙述正确的是
A. ![]() 由3种单体加聚得到
由3种单体加聚得到
B. 氨基酸溶于过量氢氧化钠溶液中生成的离子,在电场作用下向阴极移动
C. 甲苯与足量H2加成产物的一氯取代物有5种
D. 分子式为C4H6O2并能与饱和NaHCO3溶液反应生成CO2的有机物有3种(不含立体异构)
【答案】C
【解析】A. 由聚合物的结构可知,该聚合物是由1,3-丁二烯和丙烯两种单体聚合而成,故A错误;B. 氨基酸中的-COOH和NaOH反应生成羧酸根离子,带负电荷,在电场作用下向阳极移动,故B错误;C. 甲苯与足量的氢气发生加成反应生成甲基环己烷,甲基环己烷与氯气发生一元取代反应,可以取代甲基上的H原子,也可以取代环上的H原子,则甲基的邻位、间位、对位及甲基相连C原子上的H原子和甲基共5种位置,故甲基环己烷与氯气发生一元取代物的同分异构体有5种,故C正确;D. 分子式为C4H6O2并能与饱和NaHCO3溶液反应生成CO2,则该有机物中含有-COOH,所以为不饱和的一元羧酸,烃基为CH3-CH=CH-或![]() ,故符合条件的该有机物的同分异构体有2种,故D错误;答案选C。
,故符合条件的该有机物的同分异构体有2种,故D错误;答案选C。

【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是 ( )
A | B | C | D | |
反应 装置或 图像 |
|
|
|
|
实验现 象或图 像信息 | 温度计的 水银柱不 断上升 | 反应物总能 量大于生成 物总能量 | 反应开始后, 甲处液面低 于乙处液面 | 反应开始 后,针筒活 塞向右移动 |
A. A B. B C. C D. D
【题目】一氧化碳、二氧化碳的利用具有十分重要的意义,科学家提出以下几个设想:
Ⅰ.二氧化碳与氢气在催化剂作用下可制取低碳烯烃。在一恒容密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。
C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。
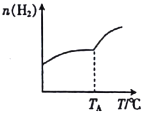
(1)其他条件不变,起始时若按1molCO2、2molH2进行投料,则CO2的转化率将____________(填“增大”“ 减小”或“不变”)。
(2)△H____________ (填“>”“<”或“不能确定”)0。
(3)若测试中体系内无氧气产生,试结合图示推断热稳定性:C2H4_______(填“>” “<”或“不能确定”)H2O。
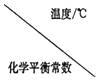
Ⅱ.甲醇是重要的化工原料,又可作为燃料,工业上可利用CO或CO2来生产燃料甲醇。已知制备甲醇的有关反应的化学方程式以及在不同温度下的化学平衡常数如下表所示。
化学反应 |
| 500 | 700 | 800 |
①2H2(g)+CO(g) | K1 | 2.5 | 0.34 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 1. 70 | 2.52 |
③3H2(g)+CO2 (g) | K3 |
请回答下列问题:
(4)根据反应比较△H1__________(填“>”“ <”或“不确定”)△H2。
(5)500℃时测得反应③在某时刻H2(g)、CO2
(6)下列措施能使反应③的平衡体系中![]() 增大的是___________(填字母)。
增大的是___________(填字母)。
A.将H2O(g)从体系中分离出去 B.充入He(g),使体系压强增大
C.升高温度 D.再充入1molH2
Ⅲ.(7)有人设想将CO按下列反应除去:2CO(g)=2C(s)+O2(g),请你分析该设想能否实现?_______________(填“能”或“不能”),依据是__________________。