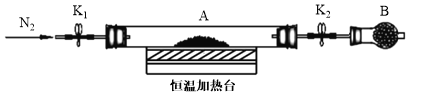
题目内容
【题目】将一定质量的Mg和Al混合物投入400mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.计算: 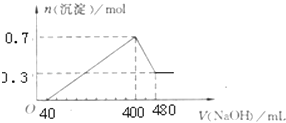
(1)Mg和Al的总质量为多少g?
(2)硫酸的物质的量浓度为多少?
(3)生成的H2物质的量为多少?
【答案】
(1)解:由图像可知,从开始至加入NaOH溶液40mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O.当V(NaOH溶液)=400mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,二者物质的量之和为0.7mol,溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(Na2SO4)等于400mL氢氧化钠溶液中含有的n(NaOH)的0.5倍.从400mL开始,NaOH溶解Al(OH)3,发生反应NaOH+Al(OH)3=NaAlO2+2H2O,当沉淀不再减少,此时全部为Mg(OH)2,物质的量为0.3mol,所以沉淀量最大时,Mg(OH)2为0.3mol,Al(OH)3为0.7mol﹣0.3mol=0.4mol,所以该阶段消耗n(NaOH)=n[Al(OH)3]=0.4mol,氢氧化钠的浓度为 ![]() =5mol/L.
=5mol/L.
由元素守恒可知n(Al)=n[Al(OH)3]=0.4mol,n(Mg)=n[Mg(OH)2]=0.3mol,故Mg和Al的总质量为0.4mol×27g/mol+0.3mol×24g/mol=18g,
答:Mg和Al的总质量为18g;
(2)解:沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(NaOH)=2n(Na2SO4)=0.4L×5mol/L=2mol,所以n(Na2SO4)=1mol,所以硫酸的浓度为 ![]() =2.5mol/L,
=2.5mol/L,
答:硫酸的浓度为2.5mol/L;
(3)解:由(1)中可知n(Al)=0.4mol,n(Mg)=0.3mol,根据电子转移守恒可知2n(H2)=3n(Al)+2n(Mg)=3×0.4mol+2×0.3mol=1.8mol,所以n(H2)=0.9mol,
答:生成的H2物质的量为0.9mol.
【解析】由图像可知,从开始至加入NaOH溶液40mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O.当V(NaOH溶液)=400mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3 , 二者物质的量之和为0.7mol,溶液中溶质为Na2SO4 , 根据钠元素守恒可知此时n(Na2SO4)等于400mL氢氧化钠溶液中含有的n(NaOH)的0.5倍.从400mL开始,NaOH溶解Al(OH)3 , 发生反应NaOH+Al(OH)3=NaAlO2+2H2O,当沉淀不再减少,此时全部为Mg(OH)2 , 物质的量为0.3mol,所以沉淀量最大时,Mg(OH)2为0.3mol,Al(OH)3为0.7mol﹣0.3mol=0.4mol,所以该阶段消耗n(NaOH)=n[Al(OH)3]=0.4mol,氢氧化钠的浓度为 ![]() =5mol/L.(1)由元素守恒可知n(Al)=n[Al(OH)3],n(Mg)=n[Mg(OH)2],在根据m=nM计算各自的质量,进而计算金属的总质量;(2)沉淀量最大,此时为Mg(OH)2和Al(OH)3 , 溶液中溶质为Na2SO4 , 根据钠元素守恒可知此时n(NaOH)=2n(Na2SO4),根据硫酸根守恒n(H2SO4)=n(Na2SO4),再根据c=
=5mol/L.(1)由元素守恒可知n(Al)=n[Al(OH)3],n(Mg)=n[Mg(OH)2],在根据m=nM计算各自的质量,进而计算金属的总质量;(2)沉淀量最大,此时为Mg(OH)2和Al(OH)3 , 溶液中溶质为Na2SO4 , 根据钠元素守恒可知此时n(NaOH)=2n(Na2SO4),根据硫酸根守恒n(H2SO4)=n(Na2SO4),再根据c= ![]() 计算;(3)根据电子转移守恒可知2n(H2)=3n(Al)+2n(Mg),据此计算n(H2).
计算;(3)根据电子转移守恒可知2n(H2)=3n(Al)+2n(Mg),据此计算n(H2).

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案【题目】一氧化碳、二氧化碳的利用具有十分重要的意义,科学家提出以下几个设想:
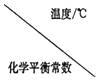
Ⅰ.二氧化碳与氢气在催化剂作用下可制取低碳烯烃。在一恒容密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。
C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。
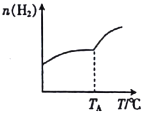
(1)其他条件不变,起始时若按1molCO2、2molH2进行投料,则CO2的转化率将____________(填“增大”“ 减小”或“不变”)。
(2)△H____________ (填“>”“<”或“不能确定”)0。
(3)若测试中体系内无氧气产生,试结合图示推断热稳定性:C2H4_______(填“>” “<”或“不能确定”)H2O。
Ⅱ.甲醇是重要的化工原料,又可作为燃料,工业上可利用CO或CO2来生产燃料甲醇。已知制备甲醇的有关反应的化学方程式以及在不同温度下的化学平衡常数如下表所示。
化学反应 |
| 500 | 700 | 800 |
①2H2(g)+CO(g) | K1 | 2.5 | 0.34 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 1. 70 | 2.52 |
③3H2(g)+CO2 (g) | K3 |
请回答下列问题:
(4)根据反应比较△H1__________(填“>”“ <”或“不确定”)△H2。
(5)500℃时测得反应③在某时刻H2(g)、CO2
(6)下列措施能使反应③的平衡体系中![]() 增大的是___________(填字母)。
增大的是___________(填字母)。
A.将H2O(g)从体系中分离出去 B.充入He(g),使体系压强增大
C.升高温度 D.再充入1molH2
Ⅲ.(7)有人设想将CO按下列反应除去:2CO(g)=2C(s)+O2(g),请你分析该设想能否实现?_______________(填“能”或“不能”),依据是__________________。