题目内容
(1)已知X、Y、Z为第三周期元素,其原子的第一至第四电离能如下表:
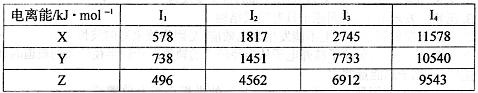
则X、Y、Z的电负性从大到小的顺序为___________ (用元素符号表示),元素Y的第一电离能大于X的第一电离能原因是__________________________________。
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小。D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取SP3杂化。
①A、B、C的第一电离能由小到大的顺序为_________________ (用元素符号表示)。
②M是含有______共价键的(填“极性”或“非极性” )
③W分子的VSEPR模型的空间构型为_________,W分子的空间构型为__________。
④AB-离子中和B2分子的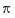 键数目比为_______________。
键数目比为_______________。
(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4S1。
①F元素在其化合物中最高化合价为_____。
②G2+离子的核外电子排布式为__________。

则X、Y、Z的电负性从大到小的顺序为___________ (用元素符号表示),元素Y的第一电离能大于X的第一电离能原因是__________________________________。
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小。D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取SP3杂化。
①A、B、C的第一电离能由小到大的顺序为_________________ (用元素符号表示)。
②M是含有______共价键的(填“极性”或“非极性” )
③W分子的VSEPR模型的空间构型为_________,W分子的空间构型为__________。
④AB-离子中和B2分子的
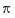 键数目比为_______________。
键数目比为_______________。(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4S1。
①F元素在其化合物中最高化合价为_____。
②G2+离子的核外电子排布式为__________。
(18分) (1)Al>Mg>Na ; 元素Mg价电子排布式为3s2,处于全充满状态,比Al的价电子排布3s23p1更稳定,则镁的第一电离能大于铝的第一电离能。
(2)① C<O<N ② 极性 ③V型 ④ 1:1 (3)① +6 ② [Ar]3d9
(2)① C<O<N ② 极性 ③V型 ④ 1:1 (3)① +6 ② [Ar]3d9
试题分析:(1)根据电离能数据可知,X的第四电离能远大于第三电离能,所以X是第ⅢA族元素。题意分析可知Y是第ⅡA族元素,Z是第IA族元素,因此XYZ分别是Al、Mg、Na。金属性越强,电负性越小,所以X、Y、Z的电负性从大到小的顺序为Al>Mg>Na。由于元素Mg价电子排布式为3s2,处于全充满状态,比Al的价电子排布3s23p1更稳定,则镁的第一电离能大于铝的第一电离能。
(2)D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取SP3杂化。又因为均是前10号元素,所以D是H元素,A是碳元素,B是氮元素,C是氧元素。因此M是甲烷,N是氨气,W是水。
①非金属性越强,第一电离能越大,但 由于氮元素中2p轨道电子处于半充满状态,稳定性强,所以氮元素的第一电离能大于氧元素的第一电离能,因此A、B、C的第一电离能由小到大的顺序为C<O<N。
②甲烷是含有极性键的非极性分子。
③根据价层电子对互斥理论可知,水中中心原子含有的孤对电子对数是(6-2×1)÷2=2,所以水是V形结构。
④CN-和氮气中均含有三键,所以
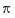 键数目比为1:1。
键数目比为1:1。(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4S1,所以EFG分别是K、Cr、Cu。
①Cr元素位于第ⅥB,在其化合物中最高化合价为+6价。
②根据工作原理可知,铜离子的核外电子排布式为[Ar]3d9。
点评:该题是高考中的常见题型,试题综合性强,难易适中,属于中等难度的试题。试题在注重对学生基础性知识巩固与训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和创新思维能力,也有利于培养学生的灵活应变能力,提高学生应试能力和学习效率。

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目

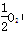 (g)===FeO(s) ΔH=-272.0 kJ·mol-1
(g)===FeO(s) ΔH=-272.0 kJ·mol-1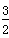 O2(g)===X2O3(s) ΔH=-1 675.7 kJ·mol-1
O2(g)===X2O3(s) ΔH=-1 675.7 kJ·mol-1