题目内容
A、B、C、D、E是元素周期表中前四周期常见元素,其原子序数依次增大。已知:
(1)常温下,某气态单质甲分子与AB分子互为等电子体,则一个甲分子中包含 个π键。
(2)关于B的氢化物,中心原子的杂化类型是 ,分子的空间构型 ,其
熔沸点比与它同主族的下一周期元素的氢化物的熔沸点高,原因是 。
(3)D元素原子核外有 种运动状态不同的电子。当C单质、D单质和NaOH溶液形成原电池时,该原电池的负极的电极反应式为: 。
(4)E元素基态原子的价电子排布式 。E晶体中微粒的堆积方式是
。
| A | 单质在自然界中硬度最大 |
| B | 原子中s能级与p能级电子数相等且有单电子 |
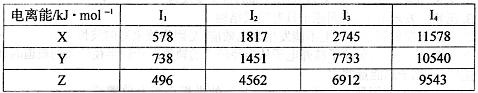
| C | C在B的下一周期,C的电离能数据(kJ ·mol-1)为:I1=738 I2=1451 I3=7732 I4=10540 |
| D | 单质密度小,较好的延展性,广泛用于食品包装,D的氧化物是两性氧化物 |
| E | 单质是一种常见金属,与B元素能形成黑色和砖红色两种氧化物 |
(2)关于B的氢化物,中心原子的杂化类型是 ,分子的空间构型 ,其
熔沸点比与它同主族的下一周期元素的氢化物的熔沸点高,原因是 。
(3)D元素原子核外有 种运动状态不同的电子。当C单质、D单质和NaOH溶液形成原电池时,该原电池的负极的电极反应式为: 。
(4)E元素基态原子的价电子排布式 。E晶体中微粒的堆积方式是
。
(11分)(1)2 (1分)
(2)sp3 (1分) V形(1分) 水分子间存在氢键(1分)
(3)13(1分) Al —3e-+4OH-=AlO2-+2H2O(2分)
(4)1s22s22p63s23p63d104s1或[Ar]3d104s1 (2分) 面心立方最密堆积(2分)
(2)sp3 (1分) V形(1分) 水分子间存在氢键(1分)
(3)13(1分) Al —3e-+4OH-=AlO2-+2H2O(2分)
(4)1s22s22p63s23p63d104s1或[Ar]3d104s1 (2分) 面心立方最密堆积(2分)
试题分析:单质在自然界中硬度最大,则A是碳元素。原子中s能级与p能级电子数相等且有单电子,且原子序数大于碳元素的,这说明B应该是氧元素。根据C的电离能数据可知,C应该是第ⅡA族元素,且位于B的下一周期,所以C是Mg元素。单质密度小,较好的延展性,广泛用于食品包装,D的氧化物是两性氧化物,这说明D应该是Al元素。单质是一种常见金属,与B元素能形成黑色和砖红色两种氧化物,因此E是铁元素。
(1)原子数和电子数分别都相等的互为等电子体,气态单质甲分子与AB分子互为等电子体,则甲应该是氮气。氮气中含有三键,而三键中含有2个π键。
(2)根据价层电子对互斥理论可知,水分子中氧原子含有的孤对电子对数是(6-2×1)÷2=2,所以水是B形结构,氧原子是sp3杂化。水分子间存在氢键,因此其熔沸点比与它同主族的下一周期元素的氢化物的熔沸点高。
(3)铝元素核外电子数是13个,则就有13种运动状态不同的电子。镁的金属性虽然强于铝的金属性,但镁和氢氧化钠溶液不反应,而铝可以,所以在该原电池中铝是负极,电极反应式是Al —3e-+4OH-=AlO2-+2H2O。
(4)根据构造原理可知,铁元素基态原子的价电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,其晶体中微粒的堆积方式是面心立方最密堆积。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和基础知识的巩固与训练。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目

 键数目比为_______________。
键数目比为_______________。
 乙
乙 丙
丙 甲
甲