题目内容
(2009·安徽理综)W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
(1)W位于元素周期表第_____周期第______族。W的气态氢化物稳定性比H2O(g)_____(填“强”或“弱”)。
(2)Y基态原子核外电子排布式是________,Y第一电离能比X的___ (填“大”或“小)
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是________________________________________________________________________。
(4)已知下列数据:Fe(s)+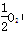 (g)===FeO(s) ΔH=-272.0 kJ·mol-1
(g)===FeO(s) ΔH=-272.0 kJ·mol-1
2X(s)+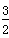 O2(g)===X2O3(s) ΔH=-1 675.7 kJ·mol-1
O2(g)===X2O3(s) ΔH=-1 675.7 kJ·mol-1
X的单质和FeO反应的热化学方程式是_________________________________________。
(1)W位于元素周期表第_____周期第______族。W的气态氢化物稳定性比H2O(g)_____(填“强”或“弱”)。
(2)Y基态原子核外电子排布式是________,Y第一电离能比X的___ (填“大”或“小)
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是________________________________________________________________________。
(4)已知下列数据:Fe(s)+
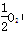 (g)===FeO(s) ΔH=-272.0 kJ·mol-1
(g)===FeO(s) ΔH=-272.0 kJ·mol-12X(s)+
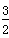 O2(g)===X2O3(s) ΔH=-1 675.7 kJ·mol-1
O2(g)===X2O3(s) ΔH=-1 675.7 kJ·mol-1X的单质和FeO反应的热化学方程式是_________________________________________。
(11分)(1)二 ⅤA 弱 (2)1s22s22p63s23p4 大
(3)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(4)3FeO(s)+2Al(s)===Al2O3(s)+3Fe(s) ΔH=-859.7 kJ·mol-1
(3)Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O (4)3FeO(s)+2Al(s)===Al2O3(s)+3Fe(s) ΔH=-859.7 kJ·mol-1
试题分析:W、Y的氧化物是导致酸雨的主要物质,则W是N元素,Y是S元素。X的基态原子核外有7个原子轨道填充了电子,且原子序数小于S的,所以X是Al元素。Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物,则Z是Cu。
(1)氮元素位于第二周期第ⅤA族。氮元素的非金属性弱于氧元素的,所以氨气的稳定性小于H2O的。
(2)根据构造原理可知,S元素基态原子的核外电子排布式是1s22s22p63s23p4。非金属性越强,第一电离能越大,则S元素的第一电离能大于Al元素的第一电离能。
(3)Y的最高价氧化物对应水化物的浓溶液是浓硫酸,所以与Cu的单质反应的化学方程式是Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。(4)根据盖斯定律可知,①×3-②即得到3FeO(s)+2Al(s)===Al2O3(s)+3Fe(s),所以该反应的反应热ΔH=-272.0 kJ·mol-1×3+1 675.7 kJ·mol-1=-859.7 kJ·mol-1。
点评:该题是中等难度的试题,也是该中的常见考点和题型。试题综合性强,难易适中,侧重对学生能力的培养和解题方法与技巧的指导和训练。该题主要是以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。

练习册系列答案
相关题目

 键数目比为_______________。
键数目比为_______________。