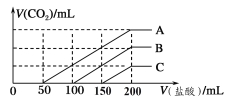
题目内容
【题目】已知:25℃时,CH3COOH和NH3H2O的电离常数相等.
(1)25℃时,取10mL 0.1mol/L醋酸溶液测得其pH=3. ①将上述(1)溶液加水稀释至1000mL,溶液pH数值范围为 , 溶液中 ![]() (填“增大”“减小”“不变”或“不能确定”).
(填“增大”“减小”“不变”或“不能确定”).
②25℃时,0.1mol/L氨水(NH3H2O溶液)的pH= . 用pH试纸测定该氨水pH的操作方法为 .
③氨水(NH3H2O溶液)电离平衡常数表达式Kb= , 25℃时,氨水电离平衡常数约为 .
(2)25℃时,现向10mL0.1mol/L氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中 ![]() (填序号). a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(填序号). a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
当加入CH3COOH溶液体积为10mL时,混合溶液的pH7(填“>”“=”“<”).
(3)某温度下,向V1mL0.1mol/LNaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图.已知:pOH=﹣lgc(OH﹣). 
①图中M,Q,N三点所示溶液中水的电离程度最大的是(填字母).
②若Q点时滴加醋酸溶液体积为V2 mL,则V1V2(填“>”“=”“<”).
③若在曲线上某一点W时加入醋酸的体积为V1 mL,则W点应位于图中曲线上Q点的(填“上方”“下方”),此时溶液中离子浓度由大到小的顺序为 .
【答案】
(1)3<PH<5;不变;11;将一小片pH试纸放在表面皿上,用玻璃棒或胶头滴管将待测液滴在试纸上,再将变色的试纸与标准比色卡对照读出数值;![]() ;1.0×10﹣5
;1.0×10﹣5
(2)b;=
(3)Q;<;下方;c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+)
【解析】解:(1)①25℃时,取10mL 0.1mol/L醋酸溶液测得其pH=3,溶液加水稀释至1000mL,氢离子浓度减小,PH大于3,醋酸电离被促进又电离出氢离子,氢离子浓度减小小于1000倍,则溶液PH小于5,溶液PH取值范围为:3<PH<5,溶液中离子浓度之比= ![]() =
= ![]() ×
× ![]() =
= ![]() ,电离平衡常数和离子积常数随温度变化,所以加水稀释
,电离平衡常数和离子积常数随温度变化,所以加水稀释 ![]() 比值不变,所以答案是:3<PH<5,不变;
比值不变,所以答案是:3<PH<5,不变;
②25℃时,CH3COOH和NH3H2O的电离常数相等,25℃时,0.1mol/L氨水(NH3H2O溶液)电离出的氢氧根离子浓度为10﹣3mol/L,溶液PH=11,pH试纸测定pH的方法是:将一小片pH试纸放在表面皿上,用玻璃棒或胶头滴管将待测液滴在试纸上,再将变色的试纸与标准比色卡对照读出数值,
所以答案是:11,将一小片pH试纸放在表面皿上,用玻璃棒或胶头滴管将待测液滴在试纸上,再将变色的试纸与标准比色卡对照读出数值;
③氨水(NH3H2O溶液)溶液中电离平衡为:NH3H2ONH4++OH﹣ , 电离平衡常数表达式Kb= ![]() ,25℃时,CH3COOH和NH3H2O的电离常数相等,25℃时,0.1mol/L氨水(NH3H2O溶液)电离出的氢氧根离子浓度为10﹣3mol/L,Kb=
,25℃时,CH3COOH和NH3H2O的电离常数相等,25℃时,0.1mol/L氨水(NH3H2O溶液)电离出的氢氧根离子浓度为10﹣3mol/L,Kb= ![]() =
= ![]() =1.0×10﹣5 ,
=1.0×10﹣5 ,
所以答案是: ![]() ,1.0×10﹣5;(2)25℃时,现向10mL0.1mol/L氨水中滴加相同浓度的CH3COOH溶液发生反应生成醋酸铵溶液,铵根离子浓度增大,一水合氨浓度减小,
,1.0×10﹣5;(2)25℃时,现向10mL0.1mol/L氨水中滴加相同浓度的CH3COOH溶液发生反应生成醋酸铵溶液,铵根离子浓度增大,一水合氨浓度减小, ![]() 比值减小,当加入CH3COOH溶液体积为10mL时,酸碱恰好完全反应生成醋酸铵溶液,25℃时,CH3COOH和NH3H2O的电离常数相等,醋酸根离子和铵根离子水解程度相同,溶液显中性,
比值减小,当加入CH3COOH溶液体积为10mL时,酸碱恰好完全反应生成醋酸铵溶液,25℃时,CH3COOH和NH3H2O的电离常数相等,醋酸根离子和铵根离子水解程度相同,溶液显中性,
所以答案是:b,=;(3)①图像分析可知N点PH>POH,溶液显碱性,M点POH>PH,溶液显酸性,酸碱抑制水的电离,Q点POH=PH,溶液显中性,水的电离程度最大,
所以答案是:Q;
②若Q点时滴加醋酸溶液体积为V2 mL,若恰好反应生成醋酸钠溶液显碱性,所以溶液呈中性醋酸应过量,V1<V2 , 所以答案是:<;
③若在曲线上某一点W时加入醋酸的体积为V1 mL,是醋酸和氢氧化钠溶液恰好反应生成醋酸钠,醋酸根离子水解溶液显碱性,PH>POH,所以溶液W点应位于图中曲线上Q点的下方,此时溶液中离子浓度由大到小的顺序为:c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+),
所以答案是:下方,c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+);
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.

【题目】已知数据:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
乙醇 | -117.3 | 78.5 | 0.789 |
乙酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.90 |
浓硫酸(98%) | — | 338.0 | 1.84 |
实验室制取乙酸乙酯的主要步骤如下:①在30 mL的大试管A中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液;②按图1连接好装置(装置气密性良好),用小火均匀地加热装有混合液的大试管3~5 min;③待试管B收集到一定量产物后停止加热,撤去试管B并用力振荡,然后静置分层;

图1
④分离出乙酸乙酯层、洗涤和干燥。
请根据题目要求回答下列问题:
(1)写出制取乙酸乙酯的化学方程式:________________________________________________________________________。
(2)上述实验中饱和碳酸钠溶液的作用是______(填字母代号)。
A.反应掉乙酸和乙醇
B.反应掉乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要用小火均匀加热,其主要原因是________________________________________________________________________。
(4)某化学课外小组设计了图2所示的制取乙酸乙酯的装置(铁架台、铁夹、加热装置均已略去),

图2
与图1所示装置相比,此装置的主要优点有________________________________________________________________。