题目内容
反应 A+B →C(△H <0)分两步进行 ① A+B→X (△H >0) ② X→C(△H <0)下列示意图中,能正确表示总反应过程中能量变化的是( )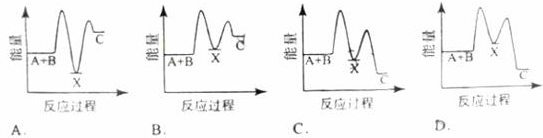
D
解析试题分析:① A+B→X (△H >0)是吸热反应,反应物的总能量小于产物的总能量,A+B的总能量小,A、C图像错误,② X→C(△H <0)是放热反应,反应物的总能量大于产物的总能量,X的能量大,D图像正确。
考点:考查放热反应和吸热反应、图像判断

在压强为2.20×104kPa、温度达到374℃时,水成为“超临界状态”,此时水可与CO2等含碳化合物反应生成有机物,这就是“水热反应”,生物质在地下高温高压条件下通过水热反应可生成石油、煤等矿物能源。下列说法错误的是
| A.火力发电厂可望利用废热,通过水热反应将二氧化碳转变为能源物质 |
| B.“水热反应”是一种复杂的物理化学变化 |
| C.超临界水与普通水的组成不相同 |
| D.随着科技的进步,通过“水热反应”获取能源有望实现地球上碳资源的和谐循环 |
已知下列热化学方程式:
Zn(s) + 1/2 O2(g)= ZnO(s) ΔH= -351.1 kJ·mol-1 ①
Hg(l) + 1/2 O2(g)= HgO(s) ΔH= -90.7 kJ·mol-1 ②
由此可知Zn(s)+ HgO(s)= ZnO(s)+ Hg(l)的反应热ΔH为
| A.-260.4 kJ·mol-1 | B.+260.4 kJ·mol-1 | C.- 441.8 kJ·mol-1 | D.+ 441.8 kJ·mol-1 |
已知化学键能:Si—Si:M KJ/mol O=O:N KJ/mol Si—O:Q KJ/mol,则Si (s) + O2 (g) =SiO2 (s); ΔH=( )
| A.—(4Q—2M—N)KJ/mol | B.—(4Q—M—2N)KJ/mol |
| C.—(2Q—M—2N)KJ/mol | D.—(2Q—2M—N)KJ/mol |
CH4、H2、CO的燃烧热分别为890.31kJ/mol、285.8kJ/mol、110.5 kJ/mol,下列热化学方程式书写正确的是
| A.CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.31kJ/mol |
| B.2H2(g)+ O2(g)= 2H2O(l)ΔH=-285.8kJ/mol |
| C.CO (g)+ H2O(g)= CO2(g)+ H2 (g)ΔH=+175.3kJ/mol |
| D.2CO (g)+ O2(g) = 2CO2(g)ΔH="-221" kJ/mol |
今有如下三个热化学方程式:
H2(g)+ O2(g)=H2O(g);△H=" a" kJ/mol
O2(g)=H2O(g);△H=" a" kJ/mol
H2(g)+ O2(g)=H2O(l);△H=" b" kJ/mol
O2(g)=H2O(l);△H=" b" kJ/mol
2H2(g)+ O2(g)=2H2O(l);△H=" c" kJ/mol
关于它们的下列表述,正确的是
| A.它们都是吸热反应 | B.a、b和c均为正值 |
| C.反应热的关系:a=b | D.反应热的关系:2b=c |
已知:H+(aq) + OH—(aq)=H2O(l) △H=—57.3kJ/mol。向1L 0.5mol/L的NaOH溶液中加入下列物质:①稀盐酸;②浓H2SO4;③稀醋酸,恰好完全反应的热效应△H1、△H2、△H3的关系正确的是
| A.△H1>△H2>△H3 | B.△H3>△H1>△H2 |
| C.△H1=△H3>△H2 | D.△H2>△H1>△H3 |
下列反应属于吸热反应的是 ( )
| A.中和反应 | B.锌与稀硫酸反应 |
| C.炭燃烧生成CO | D.炭与高温水蒸汽反应 |