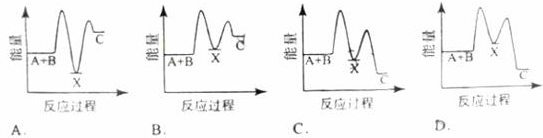
题目内容
已知下列热化学方程式:
Zn(s) + 1/2 O2(g)= ZnO(s) ΔH= -351.1 kJ·mol-1 ①
Hg(l) + 1/2 O2(g)= HgO(s) ΔH= -90.7 kJ·mol-1 ②
由此可知Zn(s)+ HgO(s)= ZnO(s)+ Hg(l)的反应热ΔH为
| A.-260.4 kJ·mol-1 | B.+260.4 kJ·mol-1 | C.- 441.8 kJ·mol-1 | D.+ 441.8 kJ·mol-1 |
A
解析试题分析:由盖斯定律可知,反应热与反应的途径无关,只与起始状态、最终状态有关,则反应相加减时,反应热也相加减;反应 Zn(s)+HgO(s)═ZnO(s)+Hg(1)可由①-②得到,所以△H=(-351.1kJ?mol-1)-(-90.7kJ?mol-1)=-260.4 kJ?mol-1,选A。
考点:考查利用盖斯定律计算反应热。

强酸与强碱的稀溶液发生中和反应的热效应:
H+(aq)+ OH-(aq) → H2O (l) +57.3kJ
向1L0.5mol/L的NaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,则恰好完全反应时的热效应Q1、Q2、Q3的关系正确的是
| A.Q1 < Q2 < Q3 | B.Q1 > Q3 > Q2 | C.Q2 > Q1 > Q3 | D.Q1 < Q3 < Q2 |
已知:P4(g)+6Cl2(g)=4PCl3(g) △H=a kJ?mol—1、P4(g)+10Cl2(g)=4PCl5(g) △H=b kJ?mol—1
P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ?mol—1,PCl3中P-Cl键的键能为1.2c kJ?mol—1。下列叙述正确的是
| A.P-P键的键能大于P-Cl键的键能 |
| B.可求Cl2(g)+ PCl3(g)=4PCl5(s)的反应热△H |
| C.Cl-Cl键的键能为(b-a+5.6c)/4 kJ?mol—1 |
| D.P-P键的键能为(5a-3b+12c)/8 kJ?mol—1 |
已知在25℃时:
①2C(石墨)+O2(g)=2CO(g) △H1=-222kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H2=-484kJ/mol
③C(石墨)+O2(g)=CO2 △H3=-394kJ/mol
则25℃时,CO(g)+H2O(g)=CO2(g)+H2(g)的反应热△H4为:
| A.-82kJ/mol | B.-41kJ/mol | C.-312kJ/mol | D.+41kJ/mol |
已知反应:H2(g) + 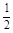 O2(g) = H2O(g) △H1
O2(g) = H2O(g) △H1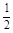 N2(g) + O2(g) = NO2 (g) △H2
N2(g) + O2(g) = NO2 (g) △H2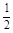 N2(g) +
N2(g) + 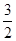 H2(g) = NH3 (g) △H3
H2(g) = NH3 (g) △H3
则反应2NH3 (g) +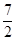 O2(g) =2NO2 (g) +3H2O(g) 的△H=
O2(g) =2NO2 (g) +3H2O(g) 的△H=
| A.2△H1+2△H2—2△H3 | B.△H1+△H2—△H3 |
| C.3△H1+2△H2+2△H3 | D.3△H1+2△H2—2△H3 |
下列既是氧化还原反应,又是吸热反应的是( )
| A.葡萄糖在人体内氧化 |
| B.锌粒与稀H2SO4反应制取H2 |
| C.Ba(OH) 2·8H2O与NH4Cl反应 |
| D.二氧化碳与赤热的炭反应生成一氧化碳 |
心脏起搏器电源—锂碘电池的电池反应为:2 Li(s) + I2 (s) =" 2" LiI(s) ΔH
已知:4 Li(s) + O2 (g) =" 2" Li2O(s) ΔH1
4 LiI(s) + O2 (g) =" 2" I2 (s) + 2 Li2O(s) ΔH2 则下列说法正确的是( )
| A.ΔH=1/2ΔH1 -ΔH2 | B.ΔH=1/2ΔH1 +ΔH2 |
| C.ΔH=1/2ΔH1 -1/2ΔH2 | D.ΔH=1/2ΔH1 +1/2ΔH2 |
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应△H1、△H2、△H3的关系正确的是
| A.△H1>△H2>△H3 | B.△H1<△H3<△H2 |
| C.△H1<△H2<△H3 | D.△H1>△H3>△H2 |