题目内容
已知化学键能:Si—Si:M KJ/mol O=O:N KJ/mol Si—O:Q KJ/mol,则Si (s) + O2 (g) =SiO2 (s); ΔH=( )
| A.—(4Q—2M—N)KJ/mol | B.—(4Q—M—2N)KJ/mol |
| C.—(2Q—M—2N)KJ/mol | D.—(2Q—2M—N)KJ/mol |
A
解析试题分析:依据化学反应的焓变等于反应物的键能之和减去生成物的键能之和及硅和二氧化硅的晶体结构分析,Si (s)为正四面体空间网状结构,1molSi (s)含有2molSi—Si,SiO2 (s)为网状结构,1mol SiO2 (s)含有4mol Si—O,则ΔH=(4Q—2M—N)KJ/mol ,选A。
考点:考查焓变的计算及硅和二氧化硅的结构。

已知在25℃时:
①2C(石墨)+O2(g)=2CO(g) △H1=-222kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H2=-484kJ/mol
③C(石墨)+O2(g)=CO2 △H3=-394kJ/mol
则25℃时,CO(g)+H2O(g)=CO2(g)+H2(g)的反应热△H4为:
| A.-82kJ/mol | B.-41kJ/mol | C.-312kJ/mol | D.+41kJ/mol |
下列既是氧化还原反应,又是吸热反应的是( )
| A.葡萄糖在人体内氧化 |
| B.锌粒与稀H2SO4反应制取H2 |
| C.Ba(OH) 2·8H2O与NH4Cl反应 |
| D.二氧化碳与赤热的炭反应生成一氧化碳 |
心脏起搏器电源—锂碘电池的电池反应为:2 Li(s) + I2 (s) =" 2" LiI(s) ΔH
已知:4 Li(s) + O2 (g) =" 2" Li2O(s) ΔH1
4 LiI(s) + O2 (g) =" 2" I2 (s) + 2 Li2O(s) ΔH2 则下列说法正确的是( )
| A.ΔH=1/2ΔH1 -ΔH2 | B.ΔH=1/2ΔH1 +ΔH2 |
| C.ΔH=1/2ΔH1 -1/2ΔH2 | D.ΔH=1/2ΔH1 +1/2ΔH2 |
已知:①N2(g)+O2(g)=2NO(g) ΔH1=+180 kJ·mol-1
②N2(g)+3H2(g)  2NH3(g) ΔH2=-92.4 kJ·mol-1
2NH3(g) ΔH2=-92.4 kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH3=-483.6 kJ·mol-1
下列说法正确的是( )
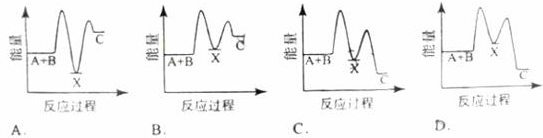
A.反应②中的能量变化如图所示,则ΔH2=E1-E3 |
| B.H2的燃烧热为241.8 kJ·mol-1 |
| C.由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2充分反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 |
| D.氨的催化氧化反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)ΔH=+906 kJ·mol-1 |
SF6是一种优良的绝缘气体,分子结构中只存在S-F键。已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F-F、S-F键需吸收的能量分别为160 kJ、330 kJ。则S(s)+3F2(g)=SF6(g)的反应热ΔH为( )
| A.-1 780 kJ·mol-1 | B.-1 220 kJ·mol-1 |
| C.-450 kJ·mol-1 | D.+430 kJ·mol-1 |
已知:C(s,石墨) ="=" C(s,金刚石) ΔH =" +1.9" kJ·mol-1。下列有关说法正确的是
| A.相同条件下,1 mol石墨比1 mol金刚石能量高 |
| B.断裂1mol石墨中的化学键吸收的能量比断裂1mol金刚石中的化学键吸收的能量少 |
| C.若:C(s,石墨) + O2(g)==CO2(g) ΔH1=-393.5 kJ?mol-1 则有:C(s,金刚石) + O2(g)==CO2(g)ΔH2=-395.4 kJ·mol-1 |
| D.其他条件不变时,加入合适的催化剂,可实现该反应的反应热转变为ΔH<0 |