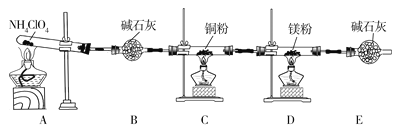
题目内容
【题目】常温下,将 1molCaC2O4 粉末置于盛有500mL蒸馏水的烧杯中,然后向烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3 固体的过程中,溶液中Ca2+ 和 CO32-的浓度变化曲线如图所示,下列说法中不正确的是
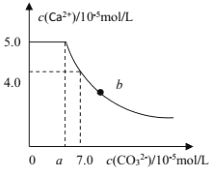
A.a=5.6
B.常温下,Ksp(CaC2O4)>Ksp(CaCO3)
C.b 点对应的溶液中,离子浓度关系为c(C2O42-) <c(CO32-)
D.若使 1molCaC2O4 全部转化为 CaCO3,至少要加入 2.12molNa2CO3
【答案】B
【解析】
A.c(CO32-)=7.0×10-5mol·L-1时,c(Ca2+)=4.0×10-5mol·L-1,Ksp(CaCO3)=7.0×10-5×4.0×10-5=2.8×10-9,当c(Ca2+)=5.0×10-5mol·L-1时,a×10-5mol·L-1=c(CO32-)=![]() =5.6×10-5mol·L-1,a=5.6,故A正确;
=5.6×10-5mol·L-1,a=5.6,故A正确;
B.1molCaC2O4 粉末置于盛有500mL蒸馏水的烧杯中,然后向烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,CaC2O4和CaCO3之间能转化,是改变离子的浓度,使沉淀的转化平衡向不同的方向移动,不能判断Ksp(CaC2O4)和Ksp(CaCO3)的大小,故B错误;
C.从图中当c(CO32-)在0~a时,溶液为CaC2O4的饱和溶液,c(C2O42-) 的最大值为5.6×10-5mol·L-1,b 点对应的溶液中,离子浓度关系为c(C2O42-) <c(CO32-),故C正确;
D.若使 1molCaC2O4 全部转化为 CaCO3,则此时溶液中c(C2O42-)=![]() =2mol·L-1,根据Ksp(CaC2O4)=c(Ca2+)·c(C2O42-)=5.0×10-5×5.0×10-5,可知此时溶液中c(Ca2+)=1.25×10-9mol·L-1,而根据Ksp(CaCO3)=2.8×10-9可知溶液中的c(CO32-)=
=2mol·L-1,根据Ksp(CaC2O4)=c(Ca2+)·c(C2O42-)=5.0×10-5×5.0×10-5,可知此时溶液中c(Ca2+)=1.25×10-9mol·L-1,而根据Ksp(CaCO3)=2.8×10-9可知溶液中的c(CO32-)=![]() == 2.240mol·L-1,故溶液中n(CO32-)=2.240mol·L-1×0.5L=1.12mol,而还有生成的1mol碳酸钙,故所需的碳酸钠的物质的量n=1.12mol+1mol=2.12mol,故D正确;
== 2.240mol·L-1,故溶液中n(CO32-)=2.240mol·L-1×0.5L=1.12mol,而还有生成的1mol碳酸钙,故所需的碳酸钠的物质的量n=1.12mol+1mol=2.12mol,故D正确;
故选B。