题目内容
15. (1)室温下,在pH=12的NaCN溶液中,由水电离的c(OH-)为10-2 mol•L-1.
(1)室温下,在pH=12的NaCN溶液中,由水电离的c(OH-)为10-2 mol•L-1.(2)等体积的下列溶液中,阳离子的总物质的量最大的是①.(填序号).
①0.2mol•L-1的CuSO4溶液
②0.1mol•L-1的Na2CO3
③0.2mol•L-1 的KCl
④0.1mol•L-1的Na2SO4
(3)浓度为0.100mol•L-1的下列各物质的溶液中,c(NH4+)由大到小的顺序②①④③(填序号).
①NH4Cl ②NH4HSO4 ③NH3•H2O ④CH3COONH4
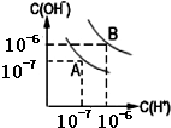
(4)水的电离平衡如图所示:
①若A点表示25℃时水的电离平衡状态,当温度上升到100℃时,水的电离平衡状态到达B点.则此时水的离子积从10-14增加到10-12.
②100℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,
该强酸的pH值pH1与强碱的pH值pH2之间应满足的关系是pHa+pHb=13.
(5)将硫酸铝溶液和碳酸氢钠溶液混合,可观察到的现象是生成无色气体和絮状沉淀,写出该反应的离子方程式:Al3++3HCO3-=Al(OH)3↓+3CO2↑.
分析 (1)依据溶液中CN-水解结合氢离子显碱性,pH=12的NaCN溶液中氢离子浓度为10-12mol/L,溶液中氢氧根离子浓度依据溶液中离子积常数计算得到;
(2)①溶液中铜离子水解时生成的氢离子是反应的铜离子的2倍;
②溶液中碳酸根离子水解需要氢离子,溶液中存在水的电离平衡,阳离子浓度大于2mol/L,但小于硫酸铜溶液中阳离子的物质的量;
③钾离子不水解;
④溶液中阳离子浓度接近2mol/L;
(3)氢离子抑制铵根离子水解,醋酸根离子促进铵根离子水解;
(4)①根据水的离子积的表达式及B点氢离子和氢氧根离子的浓度进行计算100℃时水的离子积;
②酸、碱都是强电解质,溶液呈中性说明氢离子和氢氧根离子的物质的量相等,结合水的离子积常数确定强酸的pHa与强碱的pHb之间应满足的关系;
(5)铝离子水解显酸性,碳酸氢根离子水解显碱性,混合后水解相互促进生成氢氧化铝和二氧化碳.
解答 解:(1)室温下,在pH=12的NaCN溶液中,CN-水解显碱性c(OH-)=10-2 mol/L,由水电离的c(OH-)=c(H+)=10-2 mol/L,故答案为:10-2;
(2)①溶液中铜离子水解时生成的氢离子是反应的铜离子的2倍,阳离子浓度大于2mol/L,
②溶液中碳酸根离子水解需要氢离子,溶液中存在水的电离平衡,阳离子浓度略大于2mol/L,但小于硫酸铜溶液中阳离子的物质的量;
③钾离子不水解,阳离子浓度接近2mol/L;
④溶液中阳离子浓度接近2mol/L,
所以阳离子物质的量最大的是①,
故选①;
(3)①NH4Cl是强酸弱碱盐,铵根离子能水解但较弱;
②NH4HSO4中氢离子抑制铵根离子水解;
③NH3•H2O是弱电解质,电离程度较小;
④CH3COONH4中醋酸根离子促进铵根离子水解,
所以铵根离子浓度大小顺序是:②①④③,
故答案为:②①④③;
(4)①根据图象可知,25℃时水的电离平衡常数Kw为10-14,100℃时,B点c(H+)=c(OH-)=10-6mol/L,所以100℃时水的离子积为:Kw=c(H+)•c(OH-)=10-6×10-6=10-12,
故答案为:10-14;10-12;
②100°C时,水的离子积为10-12,混合溶液呈中性,说明酸中氢离子的物质的量等于碱中氢氧根离子的物质的量,所以10-amol/L×10=10b-12 mol/L×1,所以a+b=12+1=13,
故答案为:pHa+pHb=13;
(5)铝离子水解显酸性,碳酸氢根离子水解显碱性,混合后水解相互促进生成氢氧化铝和二氧化碳;反应的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑.
点评 本题考查盐类水解的离子方程式的书写方法,理解盐类水解实质是解题关键,题目较简单.

| A. | 硫原子的原子结构示意图: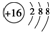 | |
| B. | 氚原子可表示为${\;}_{1}^{2}$H | |
| C. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| D. | 铁位于周期表第4周期第ⅧB族 |
| A. | C | B. | S | C. | O | D. | Si |
| A. | 第ⅢA族 | B. | 第ⅠA族 | C. | 镧系元素 | D. | 第ⅢB族 |
| A. | 79、81 | B. | 45、46 | C. | 44、45 | D. | 44、46 |
| A. | BeCl2 | B. | PCl3 | C. | PCl5 | D. | H2O |
| A. | ①和②处 | B. | ②处 | C. | ②和③处 | D. | ②③④处 |
| A. | 常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为l×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42- | |
| B. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA | |
| C. | 在中和滴定实验中,既可用标准溶液滴定待测液,也可用待测液滴定标准溶液 | |
| D. | 某一反应体系中的物质有:HC1、SnCl2、H2SnCl6、As、H3AsO3、H2O,已知As是产物之一,则该反应配平后H2O的化学计量数为6 |
 工业上制取冰晶石(Na3AlF6)的化学方程式如下:2Al(OH)3+12HF+3A=2Na3AlF6+3CO2↑+9H2O 根据题意完成下列填空:
工业上制取冰晶石(Na3AlF6)的化学方程式如下:2Al(OH)3+12HF+3A=2Na3AlF6+3CO2↑+9H2O 根据题意完成下列填空: .
.