题目内容
4.已知KMnO4、浓盐酸在常温下反应能生成Cl2.若用如图所示的实验装置来制备纯净、干燥的氯气,并实验它与金属的反应.每个虚线框表示一个单元装置,其中有错误的是( )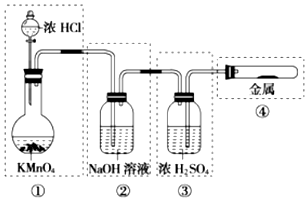
| A. | ①和②处 | B. | ②处 | C. | ②和③处 | D. | ②③④处 |
分析 KMnO4与浓HCl在常温下反应产生Cl2,浓盐酸易挥发,从发生装置生成的氯气中含有挥发的HCl和水蒸气杂质,应通入盛有饱和食盐水的洗气瓶除去HCl,然后通入盛有浓硫酸的洗气瓶进行干燥,氯气与金属反应时,气体应通入到试管底部,并用双孔橡皮塞,防止试管内压强过大,据此解答.
解答 解:KMnO4与浓HCl在常温下反应产生Cl2,故①装置正确;
浓盐酸易挥发,从发生装置生成的氯气中含有挥发的HCl和水蒸气杂质,应通入盛有饱和食盐水的洗气瓶除去HCl,不用选择氢氧化钠溶液,故②错误;
用浓硫酸干燥氯气,导管应长进短出,故③错误;
氯气与钠在试管中反应若用单孔塞,容易造成试管内压强过大,且导管应插入试管底部,故④错误;
故选:D.
点评 本题考查了氯气的实验室制备和性质的检验,熟悉反应原理和装置特点是解题关键,题目难度不大.

练习册系列答案
相关题目
14.下列各组元素中,按最高正价递增的顺序排列的是( )
| A. | N、O、F | B. | Li、Al、Mg | C. | Li、B、C | D. | Cl、Br、I |
12.a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
其中b的离子半径大于e的离子半径;d是溶于水显碱性的四原子分子;c与f作用可生成2个中性分子g.
试写出:
(1)a微粒的原子结构示意图为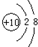
(2)b和e相应元素的最高价氧化物的水化物的碱性强弱比较为:NaOH>Mg(OH)2(用化学式表示).
(3)d的水溶液显碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-
(4)c微粒是OH-,f微粒是H3O+(用化学式表示).
(5)b相应的元素的单质与g微粒反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
| 微粒代码 | a | b | c | d | e | f | g |
| 原子核数目 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 带电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
试写出:
(1)a微粒的原子结构示意图为
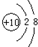
(2)b和e相应元素的最高价氧化物的水化物的碱性强弱比较为:NaOH>Mg(OH)2(用化学式表示).
(3)d的水溶液显碱性的原因(用电离方程式表示)NH3•H2O?NH4++OH-
(4)c微粒是OH-,f微粒是H3O+(用化学式表示).
(5)b相应的元素的单质与g微粒反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
9.在100mL混合酸的溶液中,硝酸的物质的量浓度为0.4mol/L,硫酸的物质的量浓度为0.2mol/L,向其中加入6.4g铜粉,微热,使其充分反应.生成NO的物质的量( )
| A. | 0.01mol | B. | 0.02mol | C. | 0.03mol | D. | 0.04mol |
13.下列叙述正确的是( )
| A. | 甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色 | |
| B. | 有机物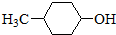 的消去产物有两种 的消去产物有两种 | |
| C. | 有机物C4H6O2能发生加聚反应,可推知其结构一定是CH2=CH-COOCH3 | |
| D. | 可用溴水鉴别苯酚、四氯化碳和乙酸 |
 (1)室温下,在pH=12的NaCN溶液中,由水电离的c(OH-)为10-2 mol•L-1.
(1)室温下,在pH=12的NaCN溶液中,由水电离的c(OH-)为10-2 mol•L-1.
