题目内容
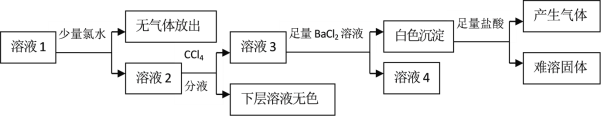
【题目】某澄清溶液中可能含有Na+、K+、NH4+、Mg2+、Fe2+、SO42﹣、SO32﹣、Cl﹣、I﹣、CO32﹣中的若干种,且离子浓度都相等。现取该溶液进行有关实验,实验结果如下图所示:
下列关于该溶液的说法中正确的是
A.通过CCl4层无色可以推知原溶液中一定不存在I-
B.向白色沉淀中加入盐酸产生气体并留有难溶固体可推知原溶液中存在SO32﹣和CO32-
C.该溶液中不可能同时存在NH4+和Cl-
D.另取该溶液加入足量浓NaOH溶液,加热,若试管口的湿润红色石蕊试纸不变蓝,则可确定原溶液中所有离子的存在情况
【答案】D
【解析】
溶液1中加入少量氯水,无气体放出,说明溶液中不含CO32﹣,因还原性SO32﹣> I-,加入少量的氯水,应先氧化SO32﹣,下层溶液无色,不能确定原溶液中是否含有I-,氯水将SO32﹣氧化为SO42﹣,但量太少,可能只部分氧化,溶液3中加入足量氯化钡溶液产生白色沉淀为亚硫酸钡和硫酸钡,沉淀加入足量盐酸时亚硫酸钡溶解,硫酸钡不溶;SO32﹣与Mg2+、Fe2+不能大量共存,则原溶液中不存在Mg2+、Fe2+;原溶液中各离子浓度都相等,根据电荷守恒,Na+、K+、NH4+至少存在其中的两种,一定无SO42﹣,可能有I-,据此分析。
A. 因还原性SO32﹣> I-,溶液1中加入少量的氯水,应先氧化SO32﹣,故通过CCl4层无色不能推知原溶液中不一定存在I-,选项A错误;
B. 溶液1中加入少量氯水,无气体放出,说明溶液中不含CO32﹣,选项B错误;
C. 根据电荷守恒,Na+、K+、NH4+至少存在其中的两种,且存在SO32﹣,若阳离子Na+、K+、NH4+存在,则存在NH4+和Cl-,选项C错误;
D. 另取该溶液加入足量浓NaOH溶液,加热,若试管口的湿润红色石蕊试纸不变蓝,则不含NH4+,原溶液中所有离子为Na+、K+、SO32﹣,选项D正确。
答案选D。

 初中暑期衔接系列答案
初中暑期衔接系列答案