题目内容
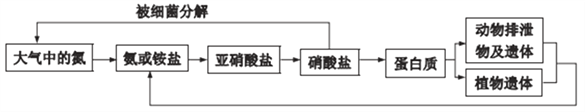
【题目】氨是动植物生长不可缺少的元素,氨在自然界中的循环对生命有重要意义。其循环示意图如下:
(1) 氨分子的电子式是__________。
(2) NH3是重要的化工原料,用途广泛,如合成尿素等。合成尿素原理分两步:
CO2(g)+ 2NH3(g)=NH2COONH4(s) △H1=- 159.5kJ/mol
NH2COONH4(s) = CO(NH2)2(s) + H2O(g) △H2=+28.5kJ/mol
则2NH3(g)+ CO2(g)=CO(NH2)2(s) + H2O(g) △H=_______kJ/mol
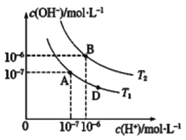
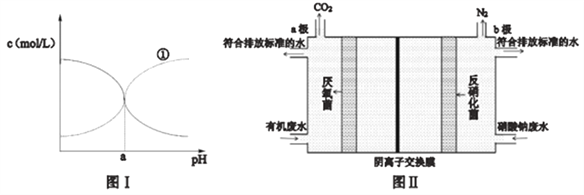
(3) 氯化铵也是氨的重要化合物,现有25℃时某浓度的氯化铵溶液中NH3·H2O和NH4+的浓度随pH的变化示意图如图I所示,则图中曲线①代表的是__________[填c(NH3·H2O)或c(NH4+)]该温度下NH3·H2O 电离平衡常数为___________(用a 的代数式表示)。
(4) 在厌氧环境下,土壤中的某些微生物(细菌)可将硝酸盐还原成氮气而实现自然界中的氮循环。某研究性学习小组由“自然界中的氮循环”产生联想:利用微生物的作用将化学能转化为电能即设计成微生物电池来同时处理含硝酸钠和有机物的废水,装置原理如图II(图中有机物用C6H12O6表示).写出电极b上的电极反应式__________________。
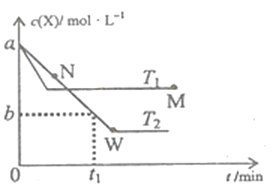
(5) 将游离态的氮转化为化合态的氮叫做氮的固定,其中一种重要的人工固氮就是合成氨。现维持温度为T压强为P的条件下,向一容积可变的密闭容器中通入1molN2和3molH2发生N2(g) +3H2(g)![]() 2NH3(g)的反应。容器容积与反应时间的数据关系如下表:
2NH3(g)的反应。容器容积与反应时间的数据关系如下表:
时间/min | 0 | 5 | 10 | 20 | 40 | 80 |
容器 容积/L | 4.00V | 3.20V | 2.80V | 2.60V | 2.50V | 2.50V |
该条件下达平衡时H2的转化率α(H2)=______,平衡常数K=_________(用V表示)
【答案】 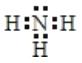 -131.0 c(NH3·H2O) 10a-14 2NO3- + 6H2O + 10e- = N2↑+ 12OH- 75%
-131.0 c(NH3·H2O) 10a-14 2NO3- + 6H2O + 10e- = N2↑+ 12OH- 75% 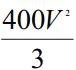
【解析】试题分析:本题是化学反应原理的综合题,主要考查盖斯定律的应用,电离平衡常数的计算,原电池原理,化学平衡的计算。
(1)NH3分子中N原子与H原子间形成共价键,NH3的电子式为![]() 。
。
(2)将反应编号,CO2(g)+2NH3(g)=NH2COONH4(s)ΔH1=-159.5kJ/mol(①式)
NH2COONH4(s)=CO(NH2)2(s)+H2O(g) ΔH2=+28.5kJ/mol(②式)
应用盖斯定律,①式+②式得,2NH3(g)+CO2(g)= CO(NH2)2(s)+H2O(g)ΔH=ΔH1+ΔH2=(-159.5kJ/mol)+(+28.5kJ/mol)=-131.0kJ/mol。
(3)曲线①随着pH的增大,浓度增大,曲线①代表c(NH3·H2O)。NH3·H2O的电离方程式为NH3·H2O![]() NH4++OH-,NH3·H2O的电离平衡常数=
NH4++OH-,NH3·H2O的电离平衡常数=![]() ,由图知当c(NH4+)=c(NH3·H2O)时pH=a,此时c(H+)=10-amol/L,c(OH-)=10a-14mol/L,则NH3·H2O的电离平衡常数=10a-14。
,由图知当c(NH4+)=c(NH3·H2O)时pH=a,此时c(H+)=10-amol/L,c(OH-)=10a-14mol/L,则NH3·H2O的电离平衡常数=10a-14。
(4)根据图示电极b上的反应为NO3-→N2,N元素的化合价由+5价降至0价,根据N守恒,2molNO3-得到10mol电子生成1molN2,2NO3-+10e-→N2↑,结合原子守恒,电极b上的电极反应式为2NO3-+10e-+6H2O=N2↑+12OH-。
(5)根据表中数据40min和80min时容器容积相等,说明达到平衡时容器容积为2.50V。设从起始到平衡转化N2物质的量为x,用三段式
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
n(起始)(mol) 1 3 0
n(转化)(mol) x 3x 2x
n(平衡)(mol) 1-x 3-3x 2x
维持温度T和压强P不变,则混合气体的体积之比等于混合气体物质的量之比, ![]() =
=![]() ,解得x=0.75mol,达到平衡时H2的转化率α(H2)=
,解得x=0.75mol,达到平衡时H2的转化率α(H2)=100%=
![]() 100%=75%。平衡时N2、H2、NH3物质的量依次为0.25mol、0.75mol、1.5mol,平衡时N2、H2、NH3物质的量浓度依次为0.1/Vmol/L、0.3/Vmol/L、0.6/Vmol/L,该反应的平衡常数K=
100%=75%。平衡时N2、H2、NH3物质的量依次为0.25mol、0.75mol、1.5mol,平衡时N2、H2、NH3物质的量浓度依次为0.1/Vmol/L、0.3/Vmol/L、0.6/Vmol/L,该反应的平衡常数K=![]() =
= =
=![]() 。
。

 名校课堂系列答案
名校课堂系列答案