题目内容
【题目】实验室常利用反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O来制取NO,当有6.4gCu参加反应时,计算:
(1)用双线桥法标出电子转移的方向和数目;
(2)能生成多少升NO(标准状况下);
(3)使生成的Cu(NO3)2中Cu2+全部转化成沉淀,则至少需要质量分数为40%密度为1.42g/ml的NaOH溶液体积。
【答案】(1)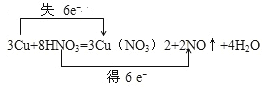 (2)1.49L (3)14mL
(2)1.49L (3)14mL
【解析】
试题分析:(1)反应中铜元素化合价从0价升高到+2价,失去2个电子。氮元素从+5价降低到+2价,得到3个电子,所以电子转移的方向和数目为 。
。
(2)6.4g铜的物质的量是6.4g÷64g/mol=0.1mol,所以根据方程式可知生成标准状况下NO的体积为![]() 。
。
(3)根据铜原子守恒可知生成氢氧化铜的物质的量是0.1mol,则需要氢氧化钠是0.2mol,所以氢氧化钠溶液的体积为![]() 。
。

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目





