题目内容
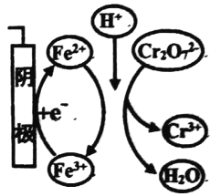
【题目】用电解法处理含Cr2072-的废水,探究不同因素对含Cr2072-废水处理的影响,结果如表所示(Cr2072-的起始浓度、体积、电压、电解时间均相同)。下列说法错误的是
实验 | i | ii | iii | iv |
|
是否加入Fe2(S04)3 | 否 | 否 | 否 | ||
是否加入H2S04 | 否 | 加入lmL | 加入lmL | 加入lmL | |
阴极村料 | 石墨 | 石墨 | 石墨 | 石墨 | |
阳极材料 | 石墨 | 石墨 | 石墨 | 铁 | |
Cr2072-的去除率 | 0.092% | 12.7% | 20.8% | 57.3% | 实验iii中Fe3+去除Cr2072-的机理 |
A. 实验ii与实验i对比,其他条件不变,增加c(H+)有利于Cr2072-的去除
B. 实验iii与实验ii对比,其他条件不变,增加c(Fe3+)有利于Cr2072-的去除
C. 实验iv中循环利用提高了Cr2072-的去除率
D. 若实验iv中去除O.OlmolCr2072-电路中共转移0.06mol电子
【答案】D
【解析】
A.实验ii与实验i对比,差别在于是否加入1mL的硫酸,加了硫酸,去除率明显提升,所以增加c(H+)有利于Cr2O72-的去除,故A正确;
B.根据表中数据可判断加入Fe2(SO4)3,增加c(Fe3+),Cr2O72-的去除率明显提升,故B正确;
C.实验iv中,在阴极,Fe3+得电子产生Fe2+,Fe2+被Cr2O72-氧化后再产生Fe3+,Fe2+循环利用提高了Cr2O72-的去除率,故C正确;
D.实验iv中,铁作阳极先失去电子变成Fe2+,然后发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,去除0.0lmolCr2O72-理论上共转移0.06mol电子,但Cr2O72-的去除率只有57.3%,所以转移的电子数小于0.06mol,故D错误。
故选D。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案【题目】一氧化二氯(Cl2O)是一种氯化剂和氧化剂,极易溶于水,与水反应生成HClO,遇有机物易燃烧或爆炸,42℃以上易分解。某化学兴趣小组设计如图装置以制备Cl2O(支撑及夹持装置已省略)。
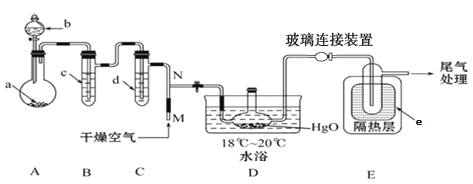
已知:① a中固体试剂是MnO2,b中试剂是浓盐酸。 ②Cl2O的部分性质如下表。
熔点 | 沸点 | 制备方法 |
-120.6 ℃ | 3.8℃ | 2HgO+2Cl2 = Cl2O+HgCl2·HgO |
请回答:
(1)指出该制备装置中存在的一个明显错误______________(经改进后进行有关实验)。
(2)装置C中盛有的试剂是______________。
(3)写出装置A中制备Cl2的化学方程式__________。
(4)装置D中采用18℃~20℃水浴的原因之一是如温度过低,反应速率慢,另一个可能的原因是 ___________。
(5)装置D、E间的连接方式与A、B、C间的连接方式有明显的差别,装置D、E间采用这种连接方式的理由是____________。
(6)Cl2O是市场上一种比较理想的饮水消毒剂,ClO2和Cl2O在消毒时自身均被还原为Cl-,则ClO2消毒能力是等质量Cl2O的_________倍(结果保留两位小数)
(7)文献报道说,Cl2O的另一种制备方法是利用Cl2与足量的Na2CO3溶液反应来制得,写出该反应的化学方程式:_________。