题目内容
4.某固体混合物由KCl、K2CO3、K2SO4和不溶于水的杂质组成.为了提纯KC1,将该混合物进行如下实验,回答相关问题.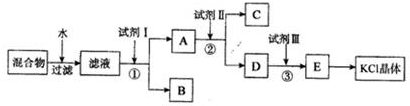
(1)试剂I的化字式为BaCl2,①中发生反应的离子方程式为Ba2++CO32-═BaCO3↓、Ba2++SO42-═BaSO4↓.
(2)试剂II的化字式为K2CO3,②中加入试剂II的目的是除去A中的Ba2+离子.
(3)试剂III的名称是盐酸,③中发生反应的离子方程式为CO32-+2H+=H2O+CO2↑.
(4)某同字根据最终所得KC1晶体和原样品的质里求算出氯化钾样品的纯度,你认为其结果是否可靠?并说明理由(不考虑实验误差)不可靠,因为所得的KCl晶体并非完全来自原样品.
分析 固体混合物由KCl、K2CO3、K2SO4和不溶于水的杂质组成,溶于水,过滤,除去不溶物杂质,滤液中含有KCl、K2CO3、K2SO4,向滤液中加入试剂1为过量BaCl2溶液,发生反应CO32-+Ba2+=BaCO3↓、SO42-+Ba2+=BaSO4↓,得到固体B为BaCO3、BaSO4,滤液A中含有KCl、BaCl2,向滤液中加入试剂Ⅱ为过量K2CO3,除去过量的钡离子,得到固体C为BaCO3,D中溶质为K2CO3和KCl,然后向溶液中加入试剂Ⅲ为过量HCl,发生反应 CO32-+2H+=H2O+CO2↑,然后蒸发溶液,溶液中HCl挥发,所以最终得到KCl晶体,以此解答该题.
解答 解:固体混合物由KCl、K2CO3、K2SO4和不溶于水的杂质组成,溶于水,过滤,除去不溶物杂质,滤液中含有KCl、K2CO3、K2SO4,向滤液中加入试剂1为过量BaCl2溶液,发生反应CO32-+Ba2+=BaCO3↓、SO42-+Ba2+=BaSO4↓,得到固体B为BaCO3、BaSO4,滤液A中含有KCl、BaCl2,向滤液中加入试剂Ⅱ为过量K2CO3,除去过量的钡离子,得到固体C为BaCO3,D中溶质为K2CO3和KCl,然后向溶液中加入试剂Ⅲ为过量HCl,发生反应 CO32-+2H+=H2O+CO2↑,然后蒸发溶液,溶液中HCl挥发,所以最终得到KCl晶体,
(1)根据上面的分析可知,试剂I的化字式为 BaCl2,①中发生反应的离子方程式为Ba2++CO32-═BaCO3↓、Ba2++SO42-═BaSO4↓,
故答案为:BaCl2;Ba2++CO32-═BaCO3↓、Ba2++SO42-═BaSO4↓;
(2)试剂II的化字式为K2CO3,②中加入K2CO3的目的是 除去A中的Ba2+离子,
故答案为:K2CO3; 除去A中的Ba2+离子;
(3)试剂III的名称是盐酸,③中发生反应的离子方程式为CO32-+2H+=H2O+CO2↑,
故答案为:盐酸;CO32-+2H+=H2O+CO2↑;
(4)根据上面流程分析可知,最后所得的氯化钾不完全是来自样品,在除杂的过程中加入了K2CO3和盐酸,会产生氯化钾,所以某同学根据最终所得KC1晶体和原样品的质里求算出氯化钾样品的纯度,其结果是不可靠的,
故答案为:不可靠,因为所得的KCl晶体并非完全来自原样品.
点评 本题考查物质的分离、提纯,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同,特别注意除杂时不能引入新杂质,更不能影响被提纯物质的性质,难度中等.

 互动英语系列答案
互动英语系列答案| A. | 福尔马林是一种良好的杀毒剂,也可用来消毒自来水 | |
| B. | 现在家用的清洁燃料主要有两类:一类是压缩天然气,另一类为液化石油气,他们都属于有机物 | |
| C. | 为了提高加酶洗衣粉的洗涤效果,先用热的自来水溶解洗衣粉 | |
| D. | 随着人们生活节奏的加快,方便的小包装食品已被广泛接受.为了防止中秋月饼等富脂食品氧化变质,延长食品的保质期,正确的做法是在包装袋中常放入生石灰 |
| M电极 | N电极 | 电解质溶液 | |
| A | 锌 | 铜 | 稀硫酸 |
| B | 铜 | 铁 | 稀盐酸 |
| C | 银 | 锌 | 硝酸银溶液 |
| D | 锌 | 铁 | 硝酸铁溶液 |
| A. | A | B. | B | C. | C | D. | D |
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO2)(mol) | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
(2)上述反应在第3s后达到平衡,能说明该反应已达到平衡状态的是bc;
a.单位时间内,消耗2molNO2的同时生成1mol的N2O4
b.容器内压强保持不变
c.v逆(NO2)=2v正(N2O4)
d.容器内密度保持不变
(3)在2s内,该反应放出(“吸收”或“放出”)2.7kJ热量.
| A. | 0.1mol/L NaOH溶液中,Na+个数为0.1NA | |
| B. | Na2O2与足量的水反应生成1molO2,转移电子数目为2NA | |
| C. | 2 L0.5 mol•L-1亚硫酸溶液中含有的H+离子数为2 NA | |
| D. | 1molO2和O3混合气体中含有氧原子的数目为2.5NA |
| A. | 11.2 L | B. | 6.27 L | C. | 5.6 L | D. | 无法确定 |
| A. | 能发生取代反应 | B. | 能被新制Cu(OH)2悬浊液氧化 | ||
| C. | 能发生加聚反应 | D. | 能使溴水褪色 |
| 阳离子 | Na+NH4+Fe3+ |
| 阴离子 | OH- Cl- SO42- |
| A. | 甲中一定含有Na+ | B. | 乙中一定含有NH4+ | ||
| C. | 丙中一定含有 Fe3+ | D. | 丙中一定含有SO42- |
 ⑩
⑩ ⑪${\;}_{17}^{35}$Cl⑫
⑪${\;}_{17}^{35}$Cl⑫