题目内容
16.若35.4g 铜银合金与2L 0.5mol/L 的硝酸溶液恰好完全反应,则收集的NO在标准状况下的体积是( )| A. | 11.2 L | B. | 6.27 L | C. | 5.6 L | D. | 无法确定 |
分析 反应方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O、3Ag+4HNO3(稀)=3AgNO3+NO↑+2H2O,设出铜银的物质的量,分别根据总质量、消耗的硝酸的物质的量列式计算出铜和银的物质的量,再根据方程式计算出生成NO的物质的量,最后根据V=nVm计算出标准状况下NO的体积.
解答 解:发生反应的有:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O、3Ag+4HNO3(稀)=3AgNO3+NO↑+2H2O,
设铜、银的物质的量分别wex、y,
根据总质量可得:①64x+108y=35.4,
根据消耗的硝酸可知:②$\frac{8}{3}$x+$\frac{4}{3}$y=0.5mol/L×2L,
根据①②可得:x=0.3mol、y=0.15mol,
0.3mol铜完全反应生成NO的物质的量为:0.3mol×$\frac{2}{3}$=0.2mol,
0.15mol银完全反应生成NO的物质的量为:0.15mol×$\frac{1}{3}$=0.05mol,
所以生成NO的总物质的量为:0.2mol+0.05mol=0.25mol,标准状况下0.25molNO的体积为:22.4L/mol×0.25mol=5.6L,
故选C.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,注意熟练掌握物质的量与摩尔质量、气体摩尔体积的关系,试题培养了学生的化学计算能力.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
14.下列关于硅单质及其化合物的说法正确的是( )
①硅是构成一些岩石和矿物的基本元素,在自然界中只以化合态的形式存在
②陶瓷、水泥、玻璃、水晶饰物都是硅酸盐制品
③硅的最高价氧化物不与任何酸反应
④SiO2高熔点、硬度大,是原子晶体,用作光导纤维
⑤硅的气态氢化物没有甲烷稳定.
①硅是构成一些岩石和矿物的基本元素,在自然界中只以化合态的形式存在
②陶瓷、水泥、玻璃、水晶饰物都是硅酸盐制品
③硅的最高价氧化物不与任何酸反应
④SiO2高熔点、硬度大,是原子晶体,用作光导纤维
⑤硅的气态氢化物没有甲烷稳定.
| A. | ①②⑤ | B. | ②③④ | C. | ①④⑤ | D. | ③④⑤ |
7.在一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解,不同时刻测得生成O2的体积(已折算为标准状况)如表.忽略溶液体积变化,下列叙述不正确的是( )
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.6 | 16.8 | 22.4 | 26.5 | 29.9 |
| A. | 2 min时H2O2的浓度c(H2O2)=0.314 mol/L | |
| B. | 0~4 min的平均反应速率v(H2O2)=3.75×10-2 mol/(L•min) | |
| C. | 0~10 min内,过氧化氢的分解速率逐渐加快 | |
| D. | 反应到6 min时,H2O2分解了50% |
11.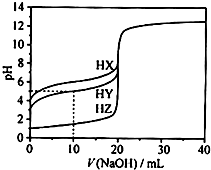 25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ滴定曲线如图所示.下列说法正确的是( )
25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ滴定曲线如图所示.下列说法正确的是( )
 25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ滴定曲线如图所示.下列说法正确的是( )
25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ滴定曲线如图所示.下列说法正确的是( )| A. | 根据滴定曲线,可得Ka(HY)≈10-9 | |
| B. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX | |
| C. | HY与HZ混合,达到平衡时:c(H+)=$\frac{Ka(HY)•c(HY)}{c({Y}^{-})}$+c(Z-)+c(OH-) | |
| D. | 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(Na+)>c(Y-)>c(X-)>c(OH-)>c(H+) |
8.下列有关化学现象及反应事实的解释中,方程式书写正确的是( )
| A. | 氢硫酸显弱酸性:H2S?2H++S2- | |
| B. | Na2CO3水溶液显弱碱性:CO32-+2H2O?H2CO3+2OH- | |
| C. | 用铜电极电解饱和NaCl溶液:阳极反应式是:2Cl--2e-=Cl2↑ | |
| D. | 用稀硝酸洗去试管中的银镜:3Ag+NO3-+4H+=3Ag++NO↑+2H2O |
5.下列实验操作:
①用50mL量筒量取5mL蒸馏水;
②称量没有腐蚀性固体药品时,把药品放在托盘上称量;
③浓硫酸沾到皮肤上要立即用大量水冲洗,并涂上稀硼酸;
④蒸馏时温度计的水银球应插在溶液中;
⑤分液漏斗分液时,上层液体应打开活塞从下口放出;
⑥固体药品用细口瓶保存.
其中错误的是( )
①用50mL量筒量取5mL蒸馏水;
②称量没有腐蚀性固体药品时,把药品放在托盘上称量;
③浓硫酸沾到皮肤上要立即用大量水冲洗,并涂上稀硼酸;
④蒸馏时温度计的水银球应插在溶液中;
⑤分液漏斗分液时,上层液体应打开活塞从下口放出;
⑥固体药品用细口瓶保存.
其中错误的是( )
| A. | ①②③ | B. | ③④ | C. | ②⑤⑥ | D. | 全部 |
6.在恒温恒容条件下,向容积为2L的密闭容器中充人2.0mol SO2和 2.0mol O2.已知:2SO2(g)+O2(g)?2SO3(g);△H=-akJ/mol(a>0,经2min达到平衡状态,反应放热0.2a kJ.下列判断正确的是( )
| A. | 在1 min时:c(SO3)+c(SO2)=1.0L/mol | |
| B. | 2 min 内:v(SO2)=0.25moL/(L•min) | |
| C. | 若再充入2mol SO3,达平衡时SO3%(质量分数)减小 | |
| D. | 反应条件相同,若起始时向反应容器中充入2mol SO3,平衡时反应吸热0.75a kJ |
 如图所示的装置中,A是氯气发生装置,C、D为气体净化装置(C中装有饱和食盐水);D 中装有浓硫酸),E 是硬质玻璃管装有细铁丝网,F为干燥的空广口瓶,烧杯G 中装有氢氧化钠溶液.试回答:
如图所示的装置中,A是氯气发生装置,C、D为气体净化装置(C中装有饱和食盐水);D 中装有浓硫酸),E 是硬质玻璃管装有细铁丝网,F为干燥的空广口瓶,烧杯G 中装有氢氧化钠溶液.试回答: