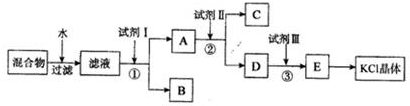
题目内容
14.甲乙丙是三种不含相同离子的可溶性强电解质.他们所含的离子如下表所示.取等质量的三种化合物配制相同体积的溶液,其物质的量浓度:c(甲)<c(乙)<c(丙),下列说法不正确的是( )| 阳离子 | Na+NH4+Fe3+ |
| 阴离子 | OH- Cl- SO42- |
| A. | 甲中一定含有Na+ | B. | 乙中一定含有NH4+ | ||
| C. | 丙中一定含有 Fe3+ | D. | 丙中一定含有SO42- |
分析 甲、乙、丙均是可溶性强电解质,则OH-只能与Na+组成NaOH,三种化合物不含相同离子,所以甲、乙、丙化合物有两种组合,第一组:NaOH、NH4Cl、Fe2(SO4)3;第二组:NaOH、(NH4)2SO4、FeCl3,根据溶质质量相等,溶液体积相等以及物质的量浓度大小可知相对分子质量:Mr(丙)>Mr(乙)>Mr(甲),以此来解答.
解答 解:甲、乙、丙均是可溶性强电解质,则OH-只能与Na+组成NaOH,三种化合物不含相同离子,所以甲、乙、丙化合物有两种组合,第一组:NaOH、NH4Cl、Fe2(SO4)3;第二组:NaOH、(NH4)2SO4、FeCl3,根据溶质质量相等,溶液体积相等以及物质的量浓度大小可知相对分子质量:Mr(丙)>Mr(乙)>Mr(甲),
第一种情况:NaOH、NH4Cl、Fe2(SO4)3,NaOH相对分子质量为40,NH4Cl相对分子质量为58.5、Fe2(SO4)3相对分子质量为400,
第二种情况:NaOH、(NH4)2SO4、FeCl3,NaOH相对分子质量为40、(NH4)2SO4相对分子质量为132、FeCl3相对分子质量为162.5,
所以甲为NaOH,乙可能是(NH4)2SO4或NH4Cl,丙为Fe2(SO4)3或FeCl3,
由上述分析可知,甲中一定含有钠离子、乙中一定含有铵根离子、丙中一定含有铁离子,但是丙中不一定含有硫酸根离子,可能含有氯离子,故D错误;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及推断甲为NaOH为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.下列实验操作:
①用50mL量筒量取5mL蒸馏水;
②称量没有腐蚀性固体药品时,把药品放在托盘上称量;
③浓硫酸沾到皮肤上要立即用大量水冲洗,并涂上稀硼酸;
④蒸馏时温度计的水银球应插在溶液中;
⑤分液漏斗分液时,上层液体应打开活塞从下口放出;
⑥固体药品用细口瓶保存.
其中错误的是( )
①用50mL量筒量取5mL蒸馏水;
②称量没有腐蚀性固体药品时,把药品放在托盘上称量;
③浓硫酸沾到皮肤上要立即用大量水冲洗,并涂上稀硼酸;
④蒸馏时温度计的水银球应插在溶液中;
⑤分液漏斗分液时,上层液体应打开活塞从下口放出;
⑥固体药品用细口瓶保存.
其中错误的是( )
| A. | ①②③ | B. | ③④ | C. | ②⑤⑥ | D. | 全部 |
2. 取x g NaHCO3和Na2O2的固体混合物放入一密闭容器中加热至250℃,充分反应后排出所有气体.将反应后的固体分成完全相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀.另一份溶于适量的水,无气体放出,再向水溶液中缓缓加入盐酸,产生气体与所加盐酸体积之间的关系如图所示.
取x g NaHCO3和Na2O2的固体混合物放入一密闭容器中加热至250℃,充分反应后排出所有气体.将反应后的固体分成完全相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀.另一份溶于适量的水,无气体放出,再向水溶液中缓缓加入盐酸,产生气体与所加盐酸体积之间的关系如图所示.
过氧化钠能发生的一些反应:2Na2O2+2H2O═4NaOH+O2↑;2Na2O2+2CO2═2NaCO3+O2↑;NaCO3+HCl═NaHCO3+NaCl;NaHCO3+HCl═NaCl+CO2↑+H2O.
试回答下列问题:
(1)加入盐酸后产生气体的在标准状况下的体积为0.448 L.
(2)将密闭容器中排出气体的化学式及对应的物质的量填入表格(有多少种填多少种)
(3)反应后的固体的成分(填化学式)NaOH、Na2CO3.
(4)x=6.09.
 取x g NaHCO3和Na2O2的固体混合物放入一密闭容器中加热至250℃,充分反应后排出所有气体.将反应后的固体分成完全相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀.另一份溶于适量的水,无气体放出,再向水溶液中缓缓加入盐酸,产生气体与所加盐酸体积之间的关系如图所示.
取x g NaHCO3和Na2O2的固体混合物放入一密闭容器中加热至250℃,充分反应后排出所有气体.将反应后的固体分成完全相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀.另一份溶于适量的水,无气体放出,再向水溶液中缓缓加入盐酸,产生气体与所加盐酸体积之间的关系如图所示.过氧化钠能发生的一些反应:2Na2O2+2H2O═4NaOH+O2↑;2Na2O2+2CO2═2NaCO3+O2↑;NaCO3+HCl═NaHCO3+NaCl;NaHCO3+HCl═NaCl+CO2↑+H2O.
试回答下列问题:
(1)加入盐酸后产生气体的在标准状况下的体积为0.448 L.
(2)将密闭容器中排出气体的化学式及对应的物质的量填入表格(有多少种填多少种)
| 化学式 | H2O | O2 | - |
| 物质的量(mol) | 0.05 | 0.00175 | - |
(4)x=6.09.
9.下列实验操作中错误的是( )
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 碘的四氯化碳溶液可用萃取的方法分离出四氯化碳 | |
| D. | 配制稀硫酸时,先向烧杯中注入适量蒸馏水,再缓慢注入浓硫酸,并用玻璃棒不断搅拌 |
19.某同学做了如下两个实验:①将少量氯气通入FeI2与淀粉的混合溶液中,溶液变蓝色;②将少量氯气通入到FeBr2与KSCN的混合溶液中溶液变红色.由上述实验可以得出的结论是( )
| A. | 氧化性:Cl2>Fe3+>Br2>I2 | |
| B. | ②发生反应Fe2++Cl2=Fe3++2Cl- | |
| C. | 实验中只有氯气发生氧化反应 | |
| D. | 实验②发生的反应中,有一个是非氧化还原反应 |
6.在恒温恒容条件下,向容积为2L的密闭容器中充人2.0mol SO2和 2.0mol O2.已知:2SO2(g)+O2(g)?2SO3(g);△H=-akJ/mol(a>0,经2min达到平衡状态,反应放热0.2a kJ.下列判断正确的是( )
| A. | 在1 min时:c(SO3)+c(SO2)=1.0L/mol | |
| B. | 2 min 内:v(SO2)=0.25moL/(L•min) | |
| C. | 若再充入2mol SO3,达平衡时SO3%(质量分数)减小 | |
| D. | 反应条件相同,若起始时向反应容器中充入2mol SO3,平衡时反应吸热0.75a kJ |
3.历史上最早应用的还原性染料--靛蓝,其结构简式如图所示,下列关于靛蓝的叙述中不正确的是( )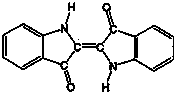

| A. | 靛蓝由碳、氢、氧、氮四种元素组成 | B. | 它的分子式是C16H10N2O2 | ||
| C. | 该物质是天然高分子化合物 | D. | 靛蓝中含苯环,属于芳香化合物 |
4.下列有关说法正确的是( )
| A. | 摩尔是表示物质数量的单位 | |
| B. | 1mol氢的质量是2g | |
| C. | O2的摩尔质量是32g | |
| D. | 每摩尔物质都含有阿伏伽德罗常数个指定微粒 |