题目内容
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测和处理.某工厂对制铬工业污泥中Cr(Ⅲ)的回收与再利用工艺如下(硫酸浸液中金属离子主要是Cr3+ , 其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+): 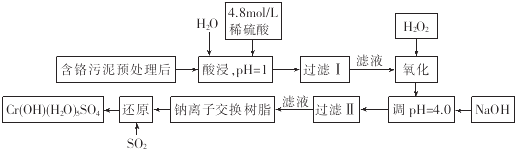
常温下部分阳离子的氢氧化物形成沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Ca2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | 9.6 | 4.2 | 9.7 | |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8.0 | 11.7 | 9.0(>9.0 溶解) |
(1)酸浸时,为了提高浸取率可采取的措施是(至少一条).
(2)调pH=4.0是为了除去
(3)钠离子交换树脂的作用原理为Mn++nNaR→MRn+nNa+ , 被交换的杂质离子是
(4)试配平下列氧化还原反应方程式:Fe2++H2O2+H+═Fe3++
(5)通入SO2的目的是 .
【答案】
(1)升高温度,搅拌,过滤后再向滤渣中加入H2SO4 (多次浸取),适当延长浸取时间
(2)Fe3+
(3)Ca2+、Al3+、Mg2+
(4)2;1;2;2;2H2O
(5)将六价铬元素还原成三价铬元素,生成Cr(OH)(H2O)5SO4
【解析】 解:(1)酸浸时,为了提高浸取率可采取的措施是:增加浸取时间、不断搅拌混合物、滤渣多次浸取等,故答案为:升高温度,搅拌,过滤后再向滤渣中加入H2SO4 (多次浸取),适当延长浸取时间;(2)硫酸浸取液中的金属离子主要是Cr3+ , 其次是Fe3+、Al3+、Ca2+和Mg2+ , 加入NaOH溶液使溶液呈碱性,溶液PH=4,Fe3+、Al3+转化为沉淀除去;故答案为:Fe3+;(3)钠离子交换树脂交换的离子是钙离子和镁离子、铝离子,因为在此之前,Fe3+被除去,故答案为:Ca2+、Al3+、Mg2+;(4)双氧水有强氧化性,能氧化还原性的物质,Fe2+有还原性,Fe2+能被双氧水氧化为铁离子,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2、1、2、2、2H2O;(5)依据流程图中的转化关系和产物,结合二氧化硫的还原性可知,二氧化硫能将六价铬元素还原成三价铬元素,生成Cr(OH)(H2O)5SO4 , 故答案为:将六价铬元素还原成三价铬元素,生成Cr(OH)(H2O)5SO4 .
(1)酸浸时,为了提高浸取率可采取的措施是延长浸取时间、加快溶解速度等措施;硫酸浸取液中的金属离子主要是Cr3+ , 其次是Fe3+、Al3+、Ca2+和Mg2+ , 酸浸是溶解物质为了提高浸取率,可以升高温度增大物质溶解度,增大接触面积增大反应速率,或加快搅拌速度等;(2)硫酸浸取液中的金属离子主要是Cr3+ , 其次是Fe3+、Al3+、Ca2+和Mg2+ , 加入NaOH溶液使溶液调节pH=4,Fe3+转化为沉淀除去;(3)钠离子交换树脂交换的离子是钙离子和镁离子、铝离子;(4)双氧水有强氧化性,能将亚铁离子氧化成铁离子,依据氧化还原反应电子守恒、原子守恒配平书写离子方程式;(5)依据流程图中的转化关系和产物,结合二氧化硫的还原性可知,二氧化硫能将六价铬元素还原成三价铬元素,生成Cr(OH)(H2O)5SO4 .

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案【题目】满足下列条件的有机物的种类数正确的是
选项 | 有机物 | 条件 | 种类数 |
A |
| 该有机物的一氯代物 | 4 |
B | C6H12O2 | 能与NaHCO3溶液反应 | 3 |
C | C5H12O | 含有2个甲基的醇 | 5 |
D | C5H10O2 | 在酸性条件下会水解生成甲和乙,且甲、乙的相对分子质量相等 | 4 |
A. A B. B C. C D. D

