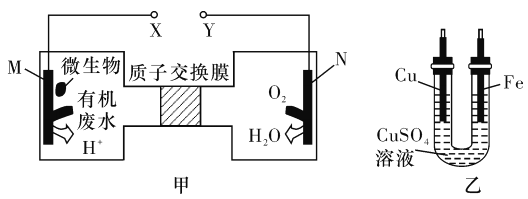
题目内容
【题目】下列哪种溶液中氯离子的物质的量浓度与50mL 0.5mol/L的氯化铝溶液中氯离子的物质的量浓度相同( )
A. 30mL 0.5mol/L的氯化镁溶液 B. 60mL 1.5mol/L的氯化钠溶液
C. 20mL 0.1mol/L的氯化钾溶液 D. 90mL 0.075mol/L 的氯化钙溶液
【答案】B
【解析】根据氯化铝的化学式结合氯化铝的电离方程式可知50mL0.5mol/L氯化铝溶液中氯离子的物质的量浓度是0.5mol/L×3=1.5mol/L,同样分析可知选项A~D中氯离子浓度分别是(mol/L)1.0、1.5、0.1、0.15,答案选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测和处理.某工厂对制铬工业污泥中Cr(Ⅲ)的回收与再利用工艺如下(硫酸浸液中金属离子主要是Cr3+ , 其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+): 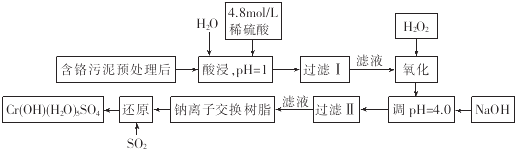
常温下部分阳离子的氢氧化物形成沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Ca2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | 9.6 | 4.2 | 9.7 | |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8.0 | 11.7 | 9.0(>9.0 溶解) |
(1)酸浸时,为了提高浸取率可采取的措施是(至少一条).
(2)调pH=4.0是为了除去
(3)钠离子交换树脂的作用原理为Mn++nNaR→MRn+nNa+ , 被交换的杂质离子是
(4)试配平下列氧化还原反应方程式:Fe2++H2O2+H+═Fe3++
(5)通入SO2的目的是 .