题目内容
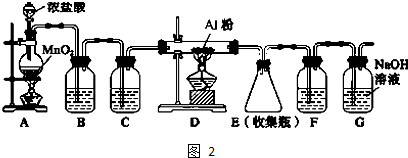
2.某校研究性学习小组设计实验,制取氯气以探究Cl2、Br2、I2的氧化性强弱(制取氯气的化学方程式为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O),实验装置如图所示:
【实验探究】
(1)制取氯气的反应??是????(填“是”或“不是”)氧化还原反应.
(2)C装置中发生反应的化学方程式为??Cl2+2NaBr=2NaCl+Br2????????????????.
(3)D装置中溶液变??蓝色????(填“黄色”或“蓝色”).
(4)E装置的作用是????吸收尾气,防止污染??????????????????.
(5)若要制取标准状况下4.48L的Cl2,需要MnO2的质量为??17.4????g.
(相对原子质量:H-1 O-16 Cl-35.5 Mn-55)
【实验讨论】
有些同学对上述实验装置持有不同看法:
甲同学认为:B装置是多余的.
乙同学认为:B装置是必须的.
你认为???甲???(填“甲”或“乙”)同学的看法是正确的.
【结论分析】
实验现象表明,C装置中有Br2生成,D装置中有I2生成,说明Cl2的氧化性比Br2、I2强.但依据本实验能否判断Br2、I2的氧化性强弱,有些同学得出不同结论:
丙同学的结论是:可以判断Br2的氧化性比I2强.
丁同学的结论是:无法判断Br2的氧化性比I2强.
你认为????丁??(填“丙”或“丁”)同学得出的结论是合理的.
分析 (1)实验室中利用二氧化锰与浓盐酸制取氯气,属于氧化还原反应;
(2)氯气置换溴化钠中的溴,据此写出方程式即可;
(3)氯气置换出碘化钠中的碘,变为单质,碘单质可以使KI的淀粉溶液变蓝;
(4)氯气有毒,需要尾气吸收;
(5)依据方程式计算即可;
【实验谈论】由于后续实验中仍然存在溶液,故B的干燥是多余的;
【结论分析】进入装置D中的不但有溴蒸汽,还可能会有过量的氯气.
解答 解:(1)验室制取氯气是二氧化锰和浓盐酸共热,反应的化学方程式为:MnO2+4HCl$\frac{\underline{\;加热\;}}{\;}$MnCl2+2H2O+C12↑,盐酸中氯元素化合价升高,是氧化还原反应,
故答案为:是;
(2)Cl2的氧化性强于Br2,故存在反应:Cl2+2NaBr=2NaCl+Br2,故答案为:Cl2+2NaBr=2NaCl+Br2;
(3)Cl2的氧化性强于I2,故存在反应:Cl2+2NaI=2NaCl+I2,碘单质可以使KI的淀粉溶液变蓝,故答案为:蓝色;
(4)氯气能溶于氢氧化钠,故E的作用是吸收尾气,故答案为:吸收尾气,防止污染;
(5)标况下,4.48L氯气的物质的量为:$\frac{44.8L}{22.4L/mol}$=0.2mol,
故依据反应MnO2+4HCl$\frac{\underline{\;加热\;}}{\;}$MnCl2+2H2O+C12↑,设需要二氧化锰的物质的量为xmol,
则有 MnO2+4HCl$\frac{\underline{\;加热\;}}{\;}$MnCl2+2H2O+C12↑
1 1
xmol 0.2mol,
解x=0.2mol,即二氧化锰的质量为:m=0.2mol×87g/mol=17.4g,
【实验讨论】由于C中反应仍然在溶液中进行,故之间的干燥是不必要的,故甲的看法是正确的,
【结论分析】进入装置D中的不但有溴蒸汽,还可能会有过量的氯气,即置换出碘的不一定是溴,还可能是氯气,故无法判断Br2的氧化性比I2强.
故答案为:17.4;甲;丁.
点评 本题主要考查的是实验室制取氯气、氯气与溴和碘的氧化性比较等,综合性较强,是一道好题.

①
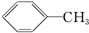 ②
② ③
③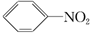 ④
④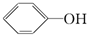 ⑤
⑤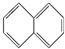 ⑥
⑥
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
| A. | SO42- OH- Cl- K+ | B. | Na+ NO3- OH- Cl- | ||
| C. | K+ Na+ NO3- Cl- | D. | K+ CO32+ H+ Ba2+ |
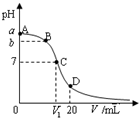 25℃,在20mL 0.1mol•L-1氨水溶液中逐滴加入0.1mol•L-1HCl溶液,其pH与所加盐酸溶液体积(V/mL)的关系如图所示,下列说法正确的是( )
25℃,在20mL 0.1mol•L-1氨水溶液中逐滴加入0.1mol•L-1HCl溶液,其pH与所加盐酸溶液体积(V/mL)的关系如图所示,下列说法正确的是( )| A. | 已知25℃时 0.1 mol•L-1氨水电离度为1.33%,则b<a<1 | |
| B. | 在C点,V1<10,且有c(NH4+)=c(Cl-)=c(OH-)=c(H+) | |
| C. | 在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | 在D点:c(NH4+)+c(NH3•H2O)=c(Cl-) |
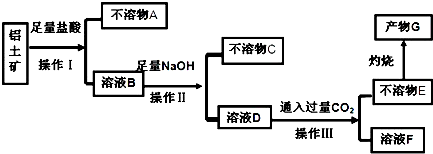
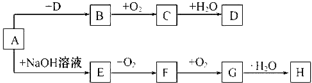 A~H 8种物质存在如下转化关系(反应条件,部分产物未标出).已知:A是酸式盐,B是能使品红溶液褪色的气体,G是红棕色气体.按要求回答问题:
A~H 8种物质存在如下转化关系(反应条件,部分产物未标出).已知:A是酸式盐,B是能使品红溶液褪色的气体,G是红棕色气体.按要求回答问题: