题目内容
Cl2、Br2、I2都具有氧化性。向NaBr、NaI的混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成不可能是( )
| A.NaCl | B.NaCl、NaBr | C.NaCl、NaBr、NaI | D.NaCl、NaI |
D
解析试题分析:Cl2、Br2、I2都具有氧化性,其氧化性由强到弱顺序为:Cl2>Br2>I2,还原性由弱到强为Cl-<Br-<I-,根据氧化还原反应的先后规律知:向含有NaBr和NaI的混合溶液中通入一定量氯气先发生反应:2NaI+Cl2=2NaCl+I2,后发生反应:2NaBr+Cl2=2NaCl+Br2,将溶液蒸干并充分灼烧,溴易挥发,碘易升华,A、当氯气过量时,上述两个反应都发生,加热过程中,溴挥发,碘升华,所以剩余固体是氯化钠,不选;B、当氯气少量时,使NaI全部反应,NaBr部分反应时,加热过程中,碘升华,剩余固体是氯化钠和溴化钠,不选;C、当氯气少量时,只有部分NaI反应,加热过程中,碘升华,剩余固体是氯化钠和溴化钠、碘化钠,不选;D、当通入氯气后,氯气先和碘离子反应,后和溴离子反应,所以固体是中不可能是氯化钠和碘化钠,故选D。
考点:考查Cl2、Br2、I2的性质及氧化还原反应的先后规律。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。下列反应可制取K2FeO4:
2Fe(OH)3+3Cl2+10KOH2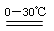 K2FeO4+KCl+8H2O
K2FeO4+KCl+8H2O
对于该反应,下列说法正确的是
| A.该反应是置换反应 | B.钾元素化合价降低 |
| C.Fe(OH)3发生还原反应 | D.Cl2是氧化剂 |
下列氧化还原反应中,水作为氧化剂的是( )
A.CO+H2O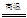 CO2+H2 CO2+H2 | B.Cl2+H2O=HCl+HClO |
| C.2Na2O2+2H2O=4NaOH+O2↑ | D.2F2+2H2O=4HF+O2 |
对剧毒的氰化物可在碱性条件下用如下方法进行处理:
2CN- +8OH-+5Cl2= 2CO2 +N2 +10Cl- +4H2O 下列判断正确的是
| A.当有0.2 mol CO2生成时,溶液中阴离子的物质的量增加1mol |
| B.该反应中,每有2molCN-反应,转移电子为10mol |
| C.上述反应中的还原剂是OH- |
| D.还原性:Cl-> CN- |
下列说法正确的是
| A.氧化还原反应的本质是有化合价的变化 |
| B.分解反应一定是氧化还原反应 |
| C.利用化合反应可制备FeCl2、Fe(OH)3 |
| D.在一定条件下能向正反两个方向进行的反应称为可逆反应 |
取相同体积的KI、Na2S、FeBr2溶液,分别通入足量的Cl2,当反应恰好完成时,消耗Cl2的体积相同(同温、同压条件下),则KI、Na2S、FeBr2溶液的物质的量浓度之比是
( )
| A.1∶1∶2 | B.2∶1∶3 | C.6∶3∶2 | D.3∶2∶1 |
常温下,下列三个反应都能进行:2NaW+X2=2NaX+W2,2NaY+W2=2NaW+Y2,2KX+Z2=2KZ+X2,由此得出正确的结论是
| A.X-、Y-、Z-、W- 中Z- 的还原性最强 | B.2Z-+Y2 = 2Y-+Z2能进行 |
| C.X2、Y2、Z2、W2中Z2的氧化性最强 | D.还原性X-﹥Y- |
人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转变为Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,主要由于维生素C具有
| A.酸性 | B.碱性 | C.氧化性 | D.还原性 |
下列变化中,需要加入氧化剂才能实现的是( )
| A.HCl→H2 | B.FeO→Fe2+ | C.SO2→SO3 | D.CO32-→CO2 |