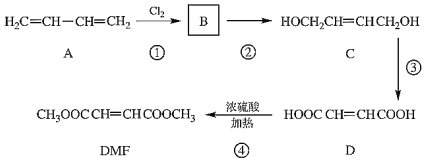
题目内容
【题目】I.25℃时,往25mL氢氧化钠标准溶液中逐滴加入0.2 mol·L-1的一元酸HA溶液,pH变化曲线如下图所示:

(1)该氢氧化钠溶液的物质的量浓度为________mol·L-1。
(2)A点对应酸的体积为12.5mL,则所得混合溶液中由水电离出的c(OH-)=_______ mol·L-1。
(3)NaA的水溶液显______性(选填“酸”、“碱”),原因是:________(用离子方程式表示)。
(4)在B点所得混合溶液中,c(Na+) 、c(A-)、c(H+)、c(OH-)由大到小的顺序是_________。
Ⅱ.在25 ℃的条件下,某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)温度、浓度相同的CH3COOH和HClO溶液,水的电离程度前者________ 后者(填“>”“=”或“<”)。
(2)相同温度下,pH相同的NaClO和CH3COOK两种溶液中,c(CH3COOK)________c(NaClO) (填“>”“=”或“<”),[c(Na+)-c(ClO-)]_______[c(K+)-c(CH3COO-)](填“>”“=”或“<”)。
【答案】0.1 1 ×10-4 碱 A-+H2O![]() HA+OH- c(Na+)=c(A-)>c(H+)=c(OH-) < > =
HA+OH- c(Na+)=c(A-)>c(H+)=c(OH-) < > =
【解析】
I.(1)由开始NaOH溶液的pH=13及水的离子积计算其浓度;
(2)根据物质的量关系可知,混合后溶液的溶质为NaA,图示信息得出,A点对应混合后的溶液pH = 10,则HA为弱酸,NaA存在水解平衡,由水电离出的氢氧根离子等于溶液中的氢氧根离子,据此分析作答;
(3)由图中a点分析等物质的量氢氧化钠与HA混合后溶液显碱性可推出,NaA存在水解平衡,据此分析判断;
(4)B点溶液显中性,c(H+) = c(OH),再结合电荷守恒规律作答;
Ⅱ.(1)根据表格可知,CH3COOH的Ka>HClO的Ka,则根据相同浓度的两种酸对水电离的抑制程度不同来分析作答;
(2)根据醋酸和次氯酸的电离平衡常数判断二者酸性强弱,酸性越强,对应的酸根离子的水解程度越弱,据此判断pH相同时醋酸钾和次氯酸钠的浓度大小;根据电荷守恒判断浓度关系。
I.(1)根据图示信息可知,开始NaOH溶液的pH=13,则c(H+) = 10-13 mol/L,根据 Kw = c(H+)×c(OH),则c(OH)=c(NaOH)=0.1 mol/L,
故答案为:0.1;
(2)由第(1)问可知,氢氧化钠的物质的量浓度为0.1 mol/L,a点时,c(NaOH)×V(NaOH) = c(HA)×V(HA),则溶液的溶质为NaA,根据图示信息可知,混合后溶液pH = 10,可推出HA为弱酸,A-水解显碱性,则溶液中的氢氧根离子浓度c(OH-) = ![]() =
= ![]() = 1 ×10-4 mol/L,则由水电离的氢氧根离子为1 ×10-4 mol/L,
= 1 ×10-4 mol/L,则由水电离的氢氧根离子为1 ×10-4 mol/L,
故答案为:1 ×10-4;
(3)a点溶质为NaA,其溶液pH = 10,则NaA存在水解平衡,其水溶液显碱性,发生的离子方程式为:A-+H2O![]() HA+OH-,
HA+OH-,
故答案为:碱;A-+H2O![]() HA+OH-;
HA+OH-;
(4)在B点所得混合溶液中,pH=7,则c(H+) = c(OH),又因为溶液中溶质为生成的NaA和过量的HA,遵循电荷守恒,故c(Na+)=c(A-)>c(H+)=c(OH-),
故答案为:c(Na+)=c(A-)>c(H+)=c(OH-);
Ⅱ.(1)因CH3COOH的Ka=1.8×10-5,HClO的Ka=3.0×10-8,则温度、浓度相同的CH3COOH和HClO溶液,CH3COOH的酸性大,即对水的电离抑制作用强,故水的电离程度前者小于后者,
故答案为:<;
(2)根据电离平衡常数可知:酸性CH3COOH>HClO,则NaClO的水解程度大于CH3COOK,所以pH相同时CH3COOK的浓度大于NaClO;由于两溶液的pH相同,则两溶液中氢离子、氢氧根离子的浓度相同,根据电荷守恒可得:[c(Na+)-c(ClO-)] = [c(K+)-c(CH3COO-)],
故答案为:>;=。