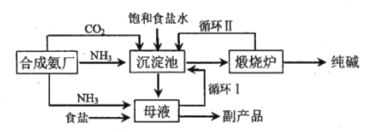
��Ŀ����
����Ŀ����֪X��Y��Z��W����Ԫ����Ԫ�����ڱ�������������ͬ�����ڵ�Ԫ�أ���ԭ��������������X��Wͬ���壬Y��ZΪͬ���ڵ�����Ԫ�ء�Wԭ�ӵ�����������Y��Zԭ������������֮�͡�Y���⻯���������3�����ۼ���Zԭ�������������Ǵ�����������3�������ƶϣ�
��1��X��Y��Z��W����Ԫ�صķ��ţ� X________��Y__________��Z____________��W��________
��2��������Ԫ���е�����Ԫ����ɵ�������ˮ��ˮ��Һ�Լ��ԵĻ�����ĵ���ʽ�ֱ�Ϊ__________________��______________________��
��3����X��Y��Z���γɵ����ӻ�������________________������W������������ˮ�����Ũ��Һ����ʱ��Ӧ�����ӷ���ʽ��________________________________________��
���𰸡�H N O Na ![]()
![]() ��
�� ![]() NH4NO3 NH4++OH-
NH4NO3 NH4++OH-![]() NH3��+H2O
NH3��+H2O
��������
X��Y��Z��W����Ԫ����Ԫ�����ڱ�������������ͬ�����ڵ�Ԫ�أ���ԭ������������������X��HԪ�أ�X��Wͬ���壬��W��NaԪ�أ�Zԭ�������������Ǵ�����������3����Z��OԪ�ء�Y��ZΪͬ���ڵ�����Ԫ�ء�Wԭ�ӵ�����������Y��Zԭ������������֮�ͣ���YΪNԪ�ء�
�������Ϸ�������1��X��Y��Z��W����Ԫ�صķ��ţ� X��H��Y��N��Z��O��W��Na��
��2��H��N��O��Na�е�����Ԫ����ɵ�������ˮ��ˮ��Һ�Լ��ԵĻ������ǰ����������ơ��������ƣ�����ʽ�ֱ�Ϊ![]() ��
��![]() ��
��![]() ��
��
��3����H��N��O���γɵ����ӻ�����������泥�NH4NO3����Na������������ˮ������NaOH�� NH4NO3��NaOH��Ӧ���������ƺͰ��������ӷ���ʽ��NH4++OH-![]() NH3��+H2O��
NH3��+H2O��

 ���ƽ̸�������ѡ����ĩ���100��ϵ�д�
���ƽ̸�������ѡ����ĩ���100��ϵ�д�����Ŀ��I��25��ʱ����25mL�������Ʊ���Һ����μ���0.2 mol��L��1��һԪ��HA��Һ��pH�仯��������ͼ��ʾ��
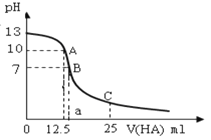
��1��������������Һ�����ʵ���Ũ��Ϊ________mol��L��1��
��2��A���Ӧ������Ϊ12.5mL�������û����Һ����ˮ�������c(OH��)��_______ mol��L��1��
��3��NaA��ˮ��Һ��______�ԣ�ѡ��������������������ԭ���ǣ�________�������ӷ���ʽ��ʾ����
��4����B�����û����Һ�У�c(Na��) ��c(A��)��c(H��)��c(OH��)�ɴ�С��˳����_________��
������25 ���������£�ijЩ����ĵ���ƽ�ⳣ����
��ѧʽ | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka��1.8��10��5 | Ka��3.0��10��8 | Ka1��4.1��10��7 Ka2��5.6��10��11 | Ka1��5.9��10��2 Ka2��6.4��10��5 |
��1���¶ȡ�Ũ����ͬ��CH3COOH��HClO��Һ��ˮ�ĵ���̶�ǰ��________ ���ߣ�����>����=������<������
��2����ͬ�¶��£�pH��ͬ��NaClO��CH3COOK������Һ�У�c(CH3COOK)________c(NaClO) ������>����=������<������[c(Na��)��c(ClO��)]_______[c(K��)��c(CH3COO��)]������>����=������<������