题目内容
(2010?德阳模拟)已知图A-J均为中学化学中常见物质,其中反应①在冶金工业上有重要用途,框图中部分产物已经略去.请回答下列问题:
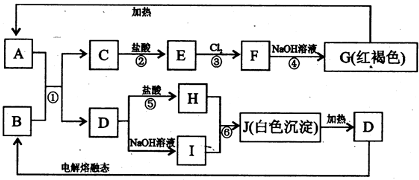
(1)E的电子式为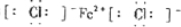
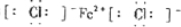 .
.
(2)反应①的化学方程式是
(3)反应⑥的离子方程式是
(4)以B、C、NaOH溶液为原料构成原电池,则该电池负极的电极反应式为:

(1)E的电子式为
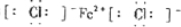
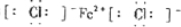
(2)反应①的化学方程式是
2Al+Fe2O3
2Fe+Al2O3
| ||
2Al+Fe2O3
2Fe+Al2O3
.
| ||
(3)反应⑥的离子方程式是
Al3++3AlO2-+6H2O=4Al(OH)3↓
Al3++3AlO2-+6H2O=4Al(OH)3↓
.按上图所示制取白色沉淀J,当生成1mol J时,则反应⑤中消耗HCl的物质的量为0.75
0.75
mol.(4)以B、C、NaOH溶液为原料构成原电池,则该电池负极的电极反应式为:
Al+4OH--3e-=AlO2-+2H2O
Al+4OH--3e-=AlO2-+2H2O
.分析:红褐色沉淀G为Fe(OH)3,则F为FeCl3,E为FeCl2,C为Fe,反应①为铝热反应,A为Fe2O3,B为Al,D为Al2O3,H为AlCl3,I为NaAlO2,J为Al(OH)3,结合对应物质的性质以及题目要求解答该题.
解答:解:红褐色沉淀G为Fe(OH)3,则F为FeCl3,E为FeCl2,C为Fe,反应①为铝热反应,A为Fe2O3,B为Al,D为Al2O3,H为AlCl3,I为NaAlO2,J为Al(OH)3,
(1)由以上分析可知E为FeCl2,电子式为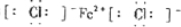 ,
,
故答案为: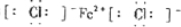 ;
;
(2)反应①为铝热反应,方程式为2Al+Fe2O3
2Fe+Al2O3,故答案为:2Al+Fe2O3
2Fe+Al2O3;
(3)反应⑥为NaAlO2、Al(OH)3互促水解反应生成氢氧化铝,反应的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓,生成1molAl(OH)3,则需0.25molAl3+,应需要0.75molHCl,
故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;0.75;
(4)以Al、Fe、NaOH溶液为原料构成原电池,则该电池负极的电极反应式为Al+4OH--3e-=AlO2-+2H2O,
故答案为:Al+4OH--3e-=AlO2-+2H2O.
(1)由以上分析可知E为FeCl2,电子式为
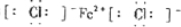 ,
,故答案为:
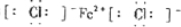 ;
;(2)反应①为铝热反应,方程式为2Al+Fe2O3
| ||
| ||
(3)反应⑥为NaAlO2、Al(OH)3互促水解反应生成氢氧化铝,反应的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓,生成1molAl(OH)3,则需0.25molAl3+,应需要0.75molHCl,
故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;0.75;
(4)以Al、Fe、NaOH溶液为原料构成原电池,则该电池负极的电极反应式为Al+4OH--3e-=AlO2-+2H2O,
故答案为:Al+4OH--3e-=AlO2-+2H2O.
点评:本题考查无机物的推断,侧重于学生的分析能力和计算能力的考查,为高考常见题型和高频考点,注意把握物质的特性以及用途,为推断题目的突破口,明确物质的种类为解答该题的关键,难度中等,注意物质的性质的学习.

练习册系列答案
相关题目