题目内容
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的危害,必须进行处理。下面是一种处理方法的工业流程: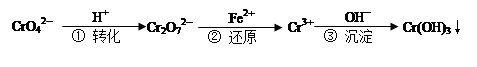
下列说法正确的是:
| A.改变反应①的平衡体系中c(H+)浓度,溶液颜色无明显变化 |
| B.若2v (Cr2O72—) ="v" (CrO42—),说明反应①达平衡状态 |
| C.反应②中还原1mol Cr2O72—,需要6 mol的Fe2+ |
D.FeSO4溶液呈酸性的原因是Fe2++ 2H2O  Fe(OH) 2↓+ 2H+ Fe(OH) 2↓+ 2H+ |
C
解析试题分析:依据化学平衡影响因素分析,氢离子浓度增大平衡正向进行,溶液颜色发生变化,变橙色,氢离子浓度减小平衡逆向进行,溶液呈黄色,故A错误;化学反应速率之比等于化学方程式中计量数之比,是正反应速率之比,不能证明反应达到平衡,故B错误;依据氧化还原反应电子守恒计算,Cr2O72-,~2Cr3+~6e-;Fe2+~Fe3+~e-,还原1mol Cr2O72-,需要6mol的Fe2+,故C正确;亚铁离子水解程度微弱不能生成氢氧化亚铁沉淀,反应过程是可逆反应,反应的离子方程式为:Fe2++2H2O?Fe(OH)2+2H+,故D错误,故选C。
考点:考查化学平衡移动原理、氧化还原反应等。

下列物质与水反应不属于氧化还原反应的是
| A.NO2 | B.CaO | C.Cl2 | D.Na2O2 |
已知:还原性HSO3¯>I¯,氧化性IO3¯> I2。
实验Ⅰ:在一定量NaHSO3的溶液中逐滴加入KIO3溶液;
实验Ⅱ:在一定量的KIO3溶液中逐滴加NaHSO3溶液。下列说法正确的是
| A.两个实验中溶液的pH变化趋势相同 |
| B.两实验中生成等量I2时,转移电子数的物质的量相同 |
| C.在实验Ⅰ的过程中,若NaHSO3初始量为3mol,当溶液中I¯与I2的物质的量之比为5∶2时,氧化产物为3.2mol |
| D.过程Ⅱ中,可以用淀粉作为滴定指示剂,判定第一阶段的反应终点 |
由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2在酸性条件下可以产生氯气。该混盐 ( )
| A.水溶液呈中性 |
| B.与硫酸反应产生1mol氯气时转移2mol电子 |
| C.水溶液不能使淀粉-KI试纸变蓝 |
| D.既含离子键又含共价键 |
在100 mL等物质的量的HBr和H2SO3的混合液里通入0.01 mol Cl2,有一半Br-变为Br2(已知Br2能氧化H2SO3)。原溶液中HBr和H2SO3的浓度都等于
| A.0.0075 mol·L-1 | B.0.008 mol·L-1 |
| C.0.075 mol·L-1 | D.0.08 mol·L-1 |
科技工作者提出用铝粉处理含亚硝酸盐废水的思路:调节亚硝酸盐废水酸碱性,使其pH>12,然后加入适量的铝粉、搅拌,从而实现预期且的。下列判断错误的是
| A.废水处理时铝单质转化为Al3+ | B.废水处理中,亚硝酸盐被还原 |
| C.处理过程中,OH一参与了反应 | D.铝粉颗粒大小影响废水处理的速率 |
锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol硝酸锌时,被还原的硝酸的物质的量为 ( )。
| A.2 mol | B.1 mol | C.0.5 mol | D.0.25 mol |
将11.9 g由Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7 g。
另取等质量的合金溶于过量稀硝酸中,生成了6.72 L NO(标准状况下),向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀的质量为( )
| A.22.1 g | B.27.2 g |
| C.30 g | D.无法计算 |
已知:①向KMnO4固体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是( )
| A.上述实验证明氧化性:MnO4->Cl2>Fe3+>I2 |
| B.上述实验中,共有两个氧化还原反应 |
| C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝 |
| D.实验②证明Fe2+既有氧化性又有还原性 |