题目内容
【题目】合成氨技术的创立开辟了人工固氮的重要途径,解决了亿万人口生存问题。
回答下列问题:
(1)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示。

由图可知合成氨反应N2(g)+3H2(g)![]() 2NH3(g)的H=___kJmol-1。该历程中速率最快的一步的活化能(E)为__kJmol-1。
2NH3(g)的H=___kJmol-1。该历程中速率最快的一步的活化能(E)为__kJmol-1。
(2)工业合成氨反应为:N2(g)+3H2(g)![]() 2NH3(g),当进料体积比V(N2)∶V(H2)=1∶3时,平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:
2NH3(g),当进料体积比V(N2)∶V(H2)=1∶3时,平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:

①500℃时,反应的平衡常数Kp(100MPa)__Kp(30MPa)。(填“<”、“=”、“>”)
②500℃、30MPa时,氢气的平衡转化率为__(保留3位有效数字),Kp=__(MPa)-2(列出计算式)。
[Kp为平衡分压代替平衡浓度计算求得的平衡常数(分压=总压×物质的量分数)]
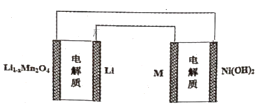
(3)科学家利用电解法在常温常压下合成氨,工作时阴极区的微观示意图如图,其中电解液为溶解有三氟甲磺酸锂和乙醇的惰性有机溶剂。

①阴极区生成NH3的电极反应式为___。
②下列说法正确的是__(填标号)。
A.该装置用金(Au)作催化剂,目的是降低N2的键能
B.三氟甲磺酸锂的作用是增强导电性
C.选择性透过膜可允许N2和NH3通过,防止H2O进入装置
【答案】-92 17 = 33.3% ![]() N2+6e-+6C2H5OH=2NH3+6C2H5O- BC
N2+6e-+6C2H5OH=2NH3+6C2H5O- BC
【解析】
(1)利用盖斯定律,起点为氮气和氢气,终点为氨气,计算反应焓变;
(2)根据平衡常数定律和公式进行计算;
(3)从图上观察,阴极区氮气与乙醇反应生成氨气和C2H5O-。
(1)由图可知,合成氨反应N2(g)+3H2(g)![]() 2NH3(g)的H=生成物总能量-反应物总能量=
2NH3(g)的H=生成物总能量-反应物总能量=![]() kJmol-1。该历程中速率最快的反应,即吸热最少的反应,活化能(E)为17kJmol-1。
kJmol-1。该历程中速率最快的反应,即吸热最少的反应,活化能(E)为17kJmol-1。
(2)①由平衡常数定义可知,500℃时,温度恒定,相同可逆反应,反应的平衡常数不变,Kp(100MPa) =Kp(30MPa)。
②500℃、30MPa时,氨气的物质的量分数为20%,在恒温恒压时,物质的量之比与体积之比相同,即进料体积比V(N2)∶V(H2)=1∶3,可假设N2加入了1mol,H2加入了3mol,平衡转化了xmol氮气:
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
反应前 1 3 0
变化量 x 3x 2x
平衡时 1-x 3-3x 2x
氨气的物质的量分数=![]() =20%。即x=
=20%。即x=![]() mol,氢气的平衡转化率为=33.3%;平衡时,氮气和氨气的物质的量一致,即物质的量分数均为20%,氢气为60%,Kp=
mol,氢气的平衡转化率为=33.3%;平衡时,氮气和氨气的物质的量一致,即物质的量分数均为20%,氢气为60%,Kp=![]() =
=![]() (MPa)-2。
(MPa)-2。
(3)①根据电解池原理,氮气与乙醇得电子生成氨气,阴极区生成NH3的电极反应式为N2+6e-+6C2H5OH=2NH3+6C2H5O-。
②A.该装置用金(Au)作催化剂,目的是降低反应活化能,不能降低N2的键能,A错误;
B.从阴极反应看,三氟甲磺酸锂并未参加反应,作用是增强导电性,B正确;
C.从图中可知,选择性透过膜可允许N2和NH3通过,防止H2O进入装置,C正确;
答案为BC。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】目前高铁酸钠(Na2FeO4)被广泛应用于水的处理,具有高效、无毒的优点。某地海水样品经Na2FeO4处理后,所含离子及其浓度见下表(H+和OH-浓度小,未列出):
离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
浓度/(mol·L-1) | a | 0.05 | 0.10 | 0.50 | 0.56 |
常温下,取一定量经Na2FeO4处理过的海水为原料制备精制食盐水和MgCl2·7H2O,过程如下:
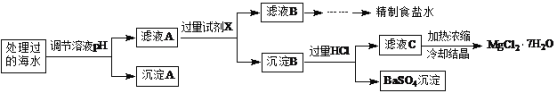
注:离子的浓度小于1.0×10-5 mol·L-1,可认为该离子不存在;Ksp[Fe(OH)3]=1.0×10-38,Ksp[Mg(OH)2]=5.0×10-12;操作过程中溶液体积的变化忽略不计。
(1)根据表中列出的离子浓度计算a=________。沉淀A是_______(填化学式)。
(2)在调节溶液pH时,理论上应调节的pH范围是_______;加入的过量试剂X为_______(填化学式)。
(3)加入过量HCl的作用为___________。
(4)用Fe作阳极、Cu作阴极,电解NaOH溶液可制得Na2FeO4,则电解过程中阳极的电极反应式为___________。