��Ŀ����
����Ŀ��Ϊ�о�ͭ��Ũ����ķ�Ӧ��ij��ѧ��ȤС���������ʵ�飮 ʵ��I����Ӧ����Ķ���̽��������ͼװ�ã��̶�װ������ȥ������ʵ��
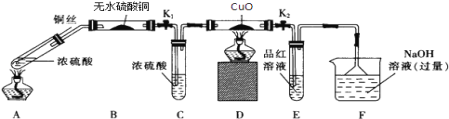
��1��Aװ�õ��Թ��з�����Ӧ�Ļ�ѧ����ʽ��________________________________��Fװ�õ�������______________________��Bװ���е�������_________________________��
��2��ʵ������У���֤��Ũ��������Ԫ�ص�������ǿ����Ԫ�ص������ǣ�Dװ����____________��Eװ����_________________________��
��3��ʵ�����ʱ��Ӧ��_________���ٹر�K1 �� K2��Ȼ��ȥ���оƾ��ơ�
��4��ʵ�������֤��Aװ���Թ��з�Ӧ���ò����Ƿ���ͭ���ӣ��轫��Һϡ�ͣ�����������___________________________________________��
ʵ���Ӧ����Ķ���̽��
��5����ͭ��Ũ���ᷴӦ�Ĺ����У������к�ɫ���ʳ��֣��Һ�ɫ����ΪCu2S������Cu2S�ķ�ӦΪa H2SO4+bCu ![]() cCu2S+dCuSO4+e H2O����a��b=_________________��
cCu2S+dCuSO4+e H2O����a��b=_________________��
��6��Ϊ�ⶨ����ͭ�IJ��ʣ����÷�Ӧ������Һ�кͺ����Ƴ�250.00mL��Һ��ȡ����Һ25.00mL��������KI��Һ�������ɵ�I2ǡ����20.00mL 0.30molL��1��Na2S2O3��Һ��Ӧ������Ӧ����ͭ������Ϊ9.6g��������ͭ�IJ���Ϊ_____________������֪2Cu2++4I��=2CuI+I2�� 2S2O32��+I2=S4O62��+2I������ע������ͭ�IJ���ָ��������ͭ��ʵ�ʲ��������۲����ı�ֵ��
���𰸡�Cu+2H2SO4��Ũ��= CuSO4+SO2��+2H2O ���ն����SO2����ֹ����Ⱦ���� ��ɫ��ĩ����ɫ ��ɫ������ɫ�ޱ仯 Ʒ����Һ��ɫ ����ͭ˿ ��Aװ������ȴ�Ļ����Һ���ձ��ڱڻ�������ʢˮ���ձ��У������Ͻ��裬�۲��Ƿ�����ɫ���� 4��5 40%
��������
���������£�Cu��Ũ���ᷢ��������ԭ��Ӧ����CuSO4��SO2��H2O��SO2�������H2O��H2O��ʹ��ˮCuSO4����ɫ������Ũ������ˮ�ԣ�����SO2��H2���л�ԭ�ԣ��ܹ���ԭCuO��SO2����Ư���ԣ���ʹƷ����Һ��ɫ��SO2�ж��������ŷŵ���������Ҫ�ü�Һ���գ�
��1��ͭ��Ũ�����ڼ��������·�����Ӧ��Cu��2H2SO4(Ũ) ![]() CuSO4��SO2����2H2O��SO2����Ư���ԣ���ʹƷ����Һ��ɫ����������SO2��SO2�ж�������β����������NaOH��Һ�����������ն����SO2����ֹ����Ⱦ��������ˮ����ͭ�������Ǽ���������Ƿ���ˮ������ͭ��Ũ���ᷴӦ����ʽ�У������к���ˮ�����װ��B�������ǰ�ɫ��ĩ����ɫ��
CuSO4��SO2����2H2O��SO2����Ư���ԣ���ʹƷ����Һ��ɫ����������SO2��SO2�ж�������β����������NaOH��Һ�����������ն����SO2����ֹ����Ⱦ��������ˮ����ͭ�������Ǽ���������Ƿ���ˮ������ͭ��Ũ���ᷴӦ����ʽ�У������к���ˮ�����װ��B�������ǰ�ɫ��ĩ����ɫ��
��2��֤��Ũ��������Ԫ�ص�������ǿ����Ԫ�أ�˵��Cu��Ũ���ᷴӦ����SO2��������H2����װ��D�й�����ɫ�ޱ仯��SO2����Ư���ԣ���ʹƷ����Һ��ɫ����װ��E��������Ʒ����Һ��ɫ��
��3��ʵ�����ʱ��Ӧ������ͭ˿���÷�Ӧֹͣ���ٹر�K1��K2����ֹC��E�е���Һ������ը�Ѳ����ܣ�
��4����֤���ɵ���Һ�к���Cu2������Ҫ���Թܵ�Һ�嵹��ˮ���ܽ⣬�۲��Ƿ������ɫ����Һ����Ϊ���з�Ӧ�����Һ�к������ᣬ��˲����ǽ�Aװ������ȴ�Ļ����Һ���ձ��ڱڻ�������ʢˮ���ձ��У������Ͻ��裬�۲��Ƿ�����ɫ���֣�
��5�����ݷ�Ӧ����ʽ��CuԪ�ػ��ϼ���0�۱�Ϊ��1�ۡ���2�ۣ�SԪ�صĻ��ϼ��ɣ�6�۱�Ϊ��2�ۣ�ת�Ƶ�����Ϊ6�����ݵ�ʧ�������غ��Լ�ԭ���غ㣬�ó�5Cu��4H2SO4![]() Cu2S��3CuSO4��4H2O����a��b=4��5��
Cu2S��3CuSO4��4H2O����a��b=4��5��
��6�����ݷ�Ӧ����ʽ�ó���2Cu2����I2��2S2O32����250mL��Һ��n(Cu2��)=![]() =0.06mol����Ӧ����ͭ�����ʵ���Ϊ9.6g/64g��mol��1=0.15mol��������ͭ�IJ���Ϊ0.06mol/0.15mol��100%=40%��
=0.06mol����Ӧ����ͭ�����ʵ���Ϊ9.6g/64g��mol��1=0.15mol��������ͭ�IJ���Ϊ0.06mol/0.15mol��100%=40%��

 �ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
�ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�