��Ŀ����
����Ŀ����1����̬ͭԭ�ӵĺ�������Ų�ʽΪ______________________ ����______��δ�ɶԵ���
��2����֪A��BΪ��������Ԫ�أ���ԭ�ӵĵ�һ�����ĵ��������±���ʾ��

�����й�A��B����������ȷ����___________
a. ���Ӱ뾶A<B b. �縺��A<B
c. ���ʵ��۵�A>B d. A��B�ĵ��ʾ�������������û���Ӧ
e. A��������������� f. A��B��������Ԫ�ع������Ӿ���
��3����ѧ��ͨ��X�����Ʋ���мȺ�����λ��,�ֺ������,��ṹʾ��ͼ�ɼ�ʾ���£�
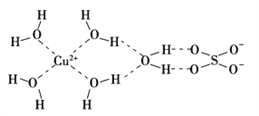
�ٵ����Ļ�ѧʽ����������ʽ��ʾΪ________________________
�ڵ�����SO42���Ŀռ乹��Ϊ_______________ ��H2O����ԭ�ӵ��ӻ�����Ϊ____________
��4��д��һ����CN����Ϊ�ȵ�����ķ��ӵĵ���ʽ______________��Na4[Fe(CN)6]�еĻ�ѧ������Ϊ_____________________
��5���þ����X�������䷨��ͭ�IJⶨ�õ����½����ͭ�ľ���Ϊ�����������ܶѻ�����֪�þ�����ܶ�Ϊ![]() g��cm��3,�����и�ԭ�ӵ���λ��Ϊ_____________��Cu��ԭ�Ӱ뾶Ϊ___________cm������٤������ΪNA��
g��cm��3,�����и�ԭ�ӵ���λ��Ϊ_____________��Cu��ԭ�Ӱ뾶Ϊ___________cm������٤������ΪNA��
���𰸡�1s22s22p63s23p63d104s1��[Ar] 3d104s1 1 bf [Cu(H20)4]SO4��H2O �������� sp3 ![]() ��
��![]() ���Ӽ�����λ�������Լ� 12
���Ӽ�����λ�������Լ� 12 ![]()
��������
������Ҫ�������ʽṹ��
��1����̬ͭԭ�ӵĺ�������Ų�ʽΪ1s22s22p63s23p63d104s1��[Ar] 3d104s1 ����1��δ�ɶԵ���
��2��A��I4ͻ����A������B��I3ͻ����BΪþ��
�����й�A��B����������ȷ����bf��
a.���Ӳ�ṹ��ͬ���ӵİ뾶���ź˵�����������С���������Ӱ뾶A<B����a��ȷ��b. ͬ����Ԫ�ش����ҵ縺�������������Ե縺��A>B ����b����ȷ��c. A��ԭ�Ӱ뾶��С�����ɵ��ӽ϶࣬ʹ��A�Ľ�������ǿ�����Ե��ʵ��۵�A>B ����C��ȷ��d. 2Mg+CO2![]() 2MgO��C ��2Al+Fe2O3
2MgO��C ��2Al+Fe2O3![]() 2Fe+Al2O3������A��B�ĵ��ʾ�������������û���Ӧ ����d��ȷ��e. �������������ᷴӦ��������Ӧ ����e��ȷ��f. �Ȼ����ǹ��ۻ���������f����ȷ����ѡbf��
2Fe+Al2O3������A��B�ĵ��ʾ�������������û���Ӧ ����d��ȷ��e. �������������ᷴӦ��������Ӧ ����e��ȷ��f. �Ȼ����ǹ��ۻ���������f����ȷ����ѡbf��
��3���ٵ����Ļ�ѧʽ����������ʽ��ʾΪ[Cu(H20)4]SO4��H2O��
�ڵ�����SO42��������ԭ����ԭ�ӵļ۲���Ӷ�Ϊ4������SO42���Ŀռ乹��Ϊ����������H2O������ԭ����ԭ�ӵļ۲���Ӷ�Ϊ4��������ԭ�ӵ��ӻ�����Ϊsp3��
��4���ȵ������ԭ�������۵�������ȣ�һ����CN����Ϊ�ȵ�����ķ��ӵĵ���ʽ��![]() ��
��![]() ��Na4[Fe(CN)6]�еĻ�ѧ������Ϊ���Ӽ�����λ�������Լ���
��Na4[Fe(CN)6]�еĻ�ѧ������Ϊ���Ӽ�����λ�������Լ���
��5�������и�ԭ�ӵ���λ��Ϊ12������ƽ������4��ͭԭ�ӣ�4��ͭԭ�ӵ�����Ϊ4��64g/NA���������Ϊ256/(��NA) cm3�������߳�a��Cuԭ�Ӱ뾶r�Ĺ�ϵΪ![]() a=4r��a3=256/(��NA)����ˣ�Cu��ԭ�Ӱ뾶Ϊ
a=4r��a3=256/(��NA)����ˣ�Cu��ԭ�Ӱ뾶Ϊ![]() cm��
cm��

����Ŀ��ij̽��С�����ñ�ͪ�������Ӧ(CH3COCH3��Br2![]() CH3COCH2Br��HBr)���о���Ӧ��Ũ���뷴Ӧ���ʵĹ�ϵ����Ӧ���� v(Br2) ͨ���ⶨ�����ɫ��ʧ�����ʱ����ȷ������һ���¶��£��������ʵ�����ݣ�
CH3COCH2Br��HBr)���о���Ӧ��Ũ���뷴Ӧ���ʵĹ�ϵ����Ӧ���� v(Br2) ͨ���ⶨ�����ɫ��ʧ�����ʱ����ȷ������һ���¶��£��������ʵ�����ݣ�
ʵ����� | ��ʼŨ��c/mol��L��1 | ����ɫ��ʧ����ʱ��t/s | ||
CH3COCH3 | HCl | Br2 | ||
�� | 0.80 | 0.20 | 0.0010 | 290 |
�� | 1.60 | 0.20 | 0.0010 | 145 |
�� | 0.80 | 0.40 | 0.0010 | 145 |
�� | 0.80 | 0.20 | 0.0020 | 580 |
����ʵ���������ó��Ľ�������ȷ����(����)
A������c(CH3COCH3)��v(Br2)����
B��ʵ��ں͢۵�v(Br2)���
C������c(HCl)��v(Br2)����
D������c(Br2)��v(Br2)����