题目内容
8.下列各原子或离子的电子排布式错误的是( )| A. | Al 1s22s22p63s23p1 | B. | O2- 1s22s22p4 | ||
| C. | Na 1s22s22p63s1 | D. | F 1s22s22p5 |
分析 原子或离子的电子排布应符合能量最低原理,一般来说离子的核外最外层达到8电子稳定结构,根据构造原理,s能级最多可容纳2个电子,p能级有3个轨道最多可容纳6个电子,电子总是优先从能量低的能层、能级排列,其中s2是原子得两个电子形成的稳定的结构,所以第三能层中的电子排布应为3s23p6,以此判断.
解答 解:A.Al原子核外有13个电子,电子排布式为:1s22s22p63s23p1,符合能量最低原理,故A正确;
B.O2-核外有10个电子,电子排布式为:1s22s22p6,故B错误;
C.Na原子核外有11个电子,核外电子排布式为:1s22s22p63s1,符合能量最低原理,故C正确;
D.F原子核外有9个电子,核外电子排布式为:1s22s22p5,符合能量最低原理,故D正确;
故选B.
点评 本题考查原子核外电子排布,题目难度不大,本题注意基态原子或离子的电子排布规律,把握书写方法.

练习册系列答案
相关题目
5. X、Y、Z、W、R、T是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
X、Y、Z、W、R、T是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
请用化学用语填空:
(1)R位于元素周期表第三周期第ⅥA族;T的基态原子核外电子排布式为1s22s22p63s23p63d54s1.
(2)用“>”或“<”填空:
(3)在加热的条件下单质X可与R的浓的最高价氧化物的水化物反应,写出该反应的化学方程式并标出电子转移的方向和数目 (或
(或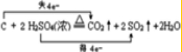 ).
).
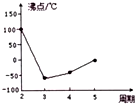
(4)Y及其同主族元素的氢化物沸点变化趋势如图所示,其中Y的氢化物沸点最高的原因是水分子间可以形成氢键,大大加强了分子间作用力,从而使水的沸点最高.
(5)在101KPa、25℃下,由最稳定单质生成1mol该化合物是的热效应称为该化合物的标准生成焓(△H).已知Z2O3标准生成焓(△H)为:△H=-399.09kJ/mol,T2O3的标准生成焓(△H)为:△H=-269.70kJ/mol,试写出单质Z和T2O3反应的热化学方程式2Al(s)+Cr2O3(s)=2Cr+Al2O3(s)△H=-129.39kJ/mol.
 X、Y、Z、W、R、T是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
X、Y、Z、W、R、T是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:| 元素 | 相关信息 |
| X | 元素最高正价与最低负价的绝对值相等 |
| Y | 是地壳中含量最多的元素 |
| Z | 元素基态原子3p能级只有一个电子 |
| W | 与Z位于同周期,能量最高的p 能级电子为半充满 |
| R | 单质为黄色固体,常存在于火山喷发口 |
| T | 元素基态原子核未成对电子最多 |
(1)R位于元素周期表第三周期第ⅥA族;T的基态原子核外电子排布式为1s22s22p63s23p63d54s1.
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 离子还原性 | 最高价氧化物的熔点 |
| W>R | Y>Z | Y<R | X<Z |
 (或
(或 ).
).(4)Y及其同主族元素的氢化物沸点变化趋势如图所示,其中Y的氢化物沸点最高的原因是水分子间可以形成氢键,大大加强了分子间作用力,从而使水的沸点最高.
(5)在101KPa、25℃下,由最稳定单质生成1mol该化合物是的热效应称为该化合物的标准生成焓(△H).已知Z2O3标准生成焓(△H)为:△H=-399.09kJ/mol,T2O3的标准生成焓(△H)为:△H=-269.70kJ/mol,试写出单质Z和T2O3反应的热化学方程式2Al(s)+Cr2O3(s)=2Cr+Al2O3(s)△H=-129.39kJ/mol.
2.有机物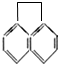 的一氯代物共有(不考虑立体异构)( )
的一氯代物共有(不考虑立体异构)( )
 的一氯代物共有(不考虑立体异构)( )
的一氯代物共有(不考虑立体异构)( )| A. | 3种 | B. | 4种 | C. | 5 种 | D. | 7种 |
20.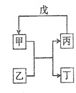 甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图示转化关系的是( )
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图示转化关系的是( )
 甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图示转化关系的是( )
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图示转化关系的是( )| 选项 | 甲 | 乙 | 丙 | 戊 |
| A | NH3 | O2 | NO | H2O |
| B | Fe | H2O | H2 | Fe2O3 |
| C | Al(OH)3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
| D | Na2O2 | CO2 | O2 | Na |
| A. | A | B. | B | C. | C | D. | D |
17.近期在西非国家爆发的埃博拉疫情已得到初步控制,已知该病毒对化学药品敏感,乙醇、高锰酸钾溶液、次氯酸钠溶液、双氧水等消毒剂可以完全灭活病毒感染性,下列有关说法正确的是( )
| A. | 乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 | |
| B. | 高锰酸钾溶液和双氧水的消毒原理相同 | |
| C. | 双氧水具有较强的腐蚀性,不能用于清洗创口 | |
| D. | 在次氯酸钠溶液中通入少量二氧化硫可得到亚硫酸钠和次氯酸 |
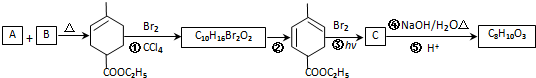
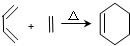 ,RCH2CH=CH2 $→_{nv}^{Br_{2}}$ RCHBrCH=CH2
,RCH2CH=CH2 $→_{nv}^{Br_{2}}$ RCHBrCH=CH2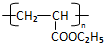 .
.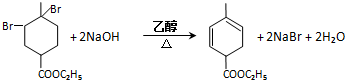 .
.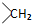 均2个,反应④的化学方程式为
均2个,反应④的化学方程式为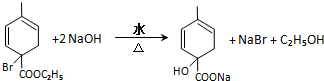 .
.
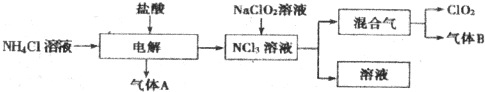
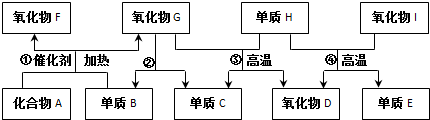
 .氧化物I中化学键类型:共价键.组成E单质的元素在元素周期表中的位置是第三周期第ⅣA族.图中物质所含元素原子的半径由大到小依次是(写元素符号)Si、C、N、O、H.
.氧化物I中化学键类型:共价键.组成E单质的元素在元素周期表中的位置是第三周期第ⅣA族.图中物质所含元素原子的半径由大到小依次是(写元素符号)Si、C、N、O、H. N2O4.
N2O4.