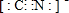题目内容
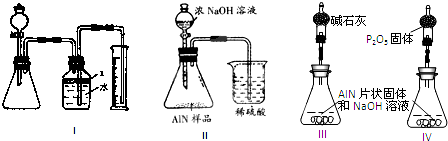
13.碱式碳酸铜是一种化工原料,化学式用mCu(OH)2•nCuCO3表示.实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:Ⅰ.用废铜屑制硫酸铜
方案1:将浓硫酸加入盛有废铜屑的大试管中加热,充分反应后过滤得到硫酸铜溶液.
方案2:将废铜屑在空气中充分灼烧,残留固体溶于稀硫酸.
Ⅱ.碱式碳酸铜的制备流程如下:
CuSO4和Na2CO3混合液$→_{①}^{加热到70℃}$$→_{②}^{NaOH溶液,调pH=8.5}$$→_{③}^{过滤}$$→_{④}^{洗涤,烘干}$碱式碳酸铜
请回答下列问题:
(1)制备硫酸铜的最佳方案为方案2(选填“方案1”或“方案2”),原因是方案2无染污,且节约原料.
(2)步骤①的加热方法为水浴加热;步骤③过滤后,滤液中有SO${\;}_{4}^{2-}$,检验SO${\;}_{4}^{2-}$的方法是取滤液少许,加入盐酸无明显现象,加入氯化钡有白色沉淀生成.
(3)步骤④洗涤的目的是除去产品表面杂质.
(4)测定碱式碳酸铜组成的方法主要有如下两种:
方法1:灼烧法.取34.6g mCu(OH)2•nCuCO3,在硬质试管中灼烧,将气体产物依次通过足量的浓硫酸、足量的碱石灰中,完全吸收后浓硫酸增重1.8g,碱石灰增重8.8g.
方法2:还原法.取一定量mCu(OH)2•nCuCO3在氢气中加强热,测反应后残留固体的质量.
①利用方法1的数据推算碱式碳酸铜的化学式为Cu(OH)2•2CuCO3.
②配平方法2的化学方程式:
mCu(OH)2•nCuCO3+(m+n)H2 $\frac{\underline{\;\;△\;\;}}{\;}$(m+n)Cu+nCO2+(2m+n)H2O.
分析 (1)从是否产生污染和原料的利用率角度分析考虑;
(2)温度恒定受热均匀,便于控制的角度分析;检验硫酸根应先加入盐酸,无现象再加入氯化钡;
(3)洗涤的目的除去表面附着的杂质;
(4)①浓硫酸吸收水,碱石灰吸收二氧化碳,所以由题可知:n(H2O)=$\frac{1.8g}{18g/mol}$=0.1 mol,n(CO2)=$\frac{8.8g}{44g/mol}$=0.2 mol,所以的最简正整为:m=1,n=2,由此分析解答;
②根据原子守恒配平,来确定各物质前面的系数.
解答 解:(1)方案1和方案2相比较,方案1产生污染性气体,且生成相同物质的量的硫酸铜时,方案1消耗的硫酸多,
故答案为:方案2;方案2无染污,且节约原料;
(2)温度恒定受热均匀,便于控制的角度分析,用水浴加热;检验硫酸根应先加入盐酸,排除CO32-、SO32- 以及Ag+的干扰,再加入氯化钡溶液有白色沉淀生成,则含有SO42-,故答案为:水浴加热;取滤液少许,加入盐酸无明显现象,加入氯化钡有白色沉淀生成;
(3)沉淀表面附有可溶性的离子应洗涤除去,故答案为:除去产品表面杂质;
(4)①浓硫酸吸收水,碱石灰吸收二氧化碳,所以由题可知:n(H2O)=$\frac{1.8g}{18g/mol}$=0.1 mol,n(CO2)=$\frac{8.8g}{44g/mol}$=0.2 mol,所以的最简正整为:m=1,n=2,则该碱式碳酸铜的化学式为:Cu(OH)2•2CuCO3,故答案为:Cu(OH)2•2CuCO3;
②根据原子守恒配平得:mCu(OH)2•nCuCO3+(m+n)H2$\frac{\underline{\;\;△\;\;}}{\;}$(m+n)Cu+nCO2+(2m+n)H2O,故答案为:(m+n);(m+n);n;(2m+n).
点评 本题考查制备硫酸铜和硫酸根离子的检验的实验设计和化学式的确定,明确离子的性质是解答本题关键,题目难度中等.

| A. | 铝与V2O5发生铝热反应 | B. | 镁粉投入到FeCl3溶液中 | ||
| C. | 碳粉与CuO混合物在试管中加热 | D. | 水蒸气通入足量Na2O2粉末 |
| A. | Al 1s22s22p63s23p1 | B. | O2- 1s22s22p4 | ||
| C. | Na 1s22s22p63s1 | D. | F 1s22s22p5 |
 一定条件,如图所示装置可实现有机物的电化学储氢(忽略其他有机物).下列说法中不正确的是( )
一定条件,如图所示装置可实现有机物的电化学储氢(忽略其他有机物).下列说法中不正确的是( )| A. | 导线中电子转移方向为C到A | |
| B. | 阳极生成2.8mol气体时,转移电子为11.2mol | |
| C. | 生成目标产物的电极反应式为C6H6+6H++6e-=C6H12 | |
| D. | 该储氢装置的电流效率η=64.3%(η=$\frac{生成目标产物消耗的电子数}{转移的电子总数}$×100%) |
CO2+H2O?H2CO3?H++HCO3-,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒.其pH随c(HCO3-):c(H2CO3)变化关系如表:
| c(HCO3-):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| PH | 6.10 | 7.35 | 7.40 | 7.45 |
| A. | pH=7.30的血液中,HCO3-的水解程度一定大于H2CO3的电离程度 | |
| B. | 人体血液酸中毒时,可注射NaHCO3溶液缓解 | |
| C. | pH=7.00的血液中,c(H2CO3)<c(HCO3-) | |
| D. | 正常人体血液中,HCO3-的水解程度大于它的电离程度 |
| A. | ①③ | B. | ②③ | C. | ①②③ | D. | ②③④ |
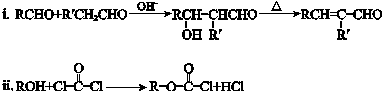
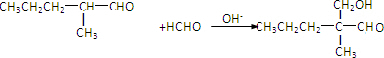 .
.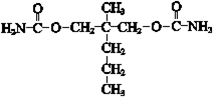 .
.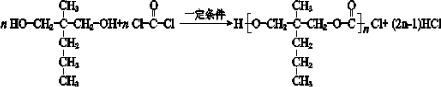 .
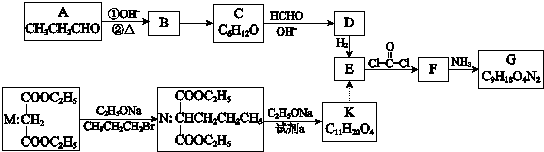
.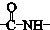 ”结构,P的核磁共振氢谱有5组峰,P能水解生成CH3CH2NH2和甲,1mol甲跟足量钠反应生成2mol H2.则P的结构简式是
”结构,P的核磁共振氢谱有5组峰,P能水解生成CH3CH2NH2和甲,1mol甲跟足量钠反应生成2mol H2.则P的结构简式是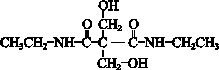 .
.