题目内容
【题目】已知反应MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O中,若二氧化锰与足量的浓盐酸反应制得3.55gCl2 , 通过计算回答:用双线桥标出反应中电子转移的方向和数目 , 参加反应的HCl的物质的量为 , 其中被氧化的HCl的质量 .
MnCl2+Cl2↑+2H2O中,若二氧化锰与足量的浓盐酸反应制得3.55gCl2 , 通过计算回答:用双线桥标出反应中电子转移的方向和数目 , 参加反应的HCl的物质的量为 , 其中被氧化的HCl的质量 .
【答案】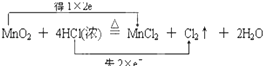 ;0.2mol;3.65g
;0.2mol;3.65g
【解析】解:Mn元素的化合价从+4价降为+2价,Cl元素从﹣1价升高为0价,反应中转移2个电子,则用双线桥表示为 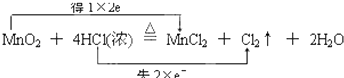 ,
,
n(Cl2)= ![]() =0.05mol,则参加反应的HCl为0.05mol×4=0.2mol,其中被氧化的HCl占二分之一,即为0.1mol,其质量为0.1mol×36.5g/mol=3.65g;
=0.05mol,则参加反应的HCl为0.05mol×4=0.2mol,其中被氧化的HCl占二分之一,即为0.1mol,其质量为0.1mol×36.5g/mol=3.65g;
所以答案是: 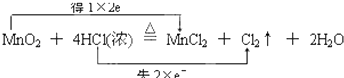 ;0.2mol;3.65g.
;0.2mol;3.65g.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目