题目内容
【题目】碳、氮及其化合物广泛存在于自然界中,回答下列问题:
(1)碳在形成化合物时,其键型以共价键为主,原因是__________。
(2)CS2分子中,共价键的类型有_______ , C原子的杂化轨道类型是______,写出两个与CS2具有相同空间构型的分子或离子_______。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是______;
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(g)+ N2H4(g)=2N2(g)+4H2O(g) △H=-1038.7kJ/mol。若该反应中有4molN-H键断裂,则形成的π键有___mol。
③肼能与硫酸反应生成N2H6SO4, N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在____ (填标号)。
a.离子键 b.共价键 c.配位键 d.范德华力
(4)碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图29所示。K位于立方体的棱上和立方体的内部,此化合物的化学式为______。其晶胞参数(晶胞边长)为1.4nm,晶体密度为____g/cm3。
【答案】 碳原子最外层有4个电子,不容易得或失电子形成稳定结构 π、δ sp CO2、SCN- 三角锥形 3 d K3C60 2
【解析】(1)共价键为原子之间以共用电子对成键,碳原子核外有4个电子,且元素的非金属性较弱,但半径较小,反应中难以失去或得到电子形成稳定结构;
(2)CS2分子的结构式为S=C=S,含有δ键和π键,CS2分子中C原子形成2个δ键,孤对电子数为![]() =0,则为sp杂化;等电子体具有相似的结构,CO2、SCN-与CS2是等电子体,则具有相同空间构型;
=0,则为sp杂化;等电子体具有相似的结构,CO2、SCN-与CS2是等电子体,则具有相同空间构型;
(3)①NH3分子中氮原子含有3个共价键和一个孤电子对,所以空间构型是三角锥型;
②N2O4+2N2H4═3N2+4H2O,若该反应中有4mol N-H键断裂,即有1mol N2H4参加反应,生成1.5mol N2,形成π键的物质的量为2×1.5mol=3mol;
③肼与硫酸反应的离子方程式为N2H4+2H+═N2H62+,N2H6SO4晶体类型与硫酸铵相同,N2H62+中的化学键是共价键与配位键,N2H62+与SO42-之间是离子键,不存在范德华力,故答案为d;
(4)K位于棱和体心,晶胞中的个数为12×![]() +9=12,C60位于定点和面心,个数为8×
+9=12,C60位于定点和面心,个数为8×![]() +6×
+6×![]() =4,化学式为K3C60,则晶胞的质量为
=4,化学式为K3C60,则晶胞的质量为![]() g,其晶胞参数为1.4nm=1.4×10-7cm,则体积为(1.4×10-7)3cm3,所以密度为
g,其晶胞参数为1.4nm=1.4×10-7cm,则体积为(1.4×10-7)3cm3,所以密度为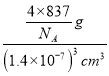 =2.0gcm-3。
=2.0gcm-3。