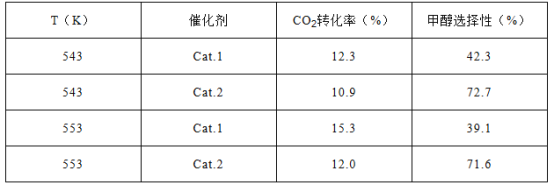
题目内容
【题目】H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示,初始溶液为氢氧化钠溶液:下列说法正确的是( )
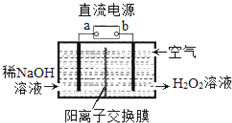
A. a为负极
B. 通入空气的电极反应式为O2+2e﹣+2H+═H2O2
C. 电解一段时间后,左侧溶液pH降低
D. 若生成17g双氧水,则有1molH+从左侧向右侧迁移
【答案】C
【解析】由题给信息氧气在阴极还原转化为H2O2和稀碱的混合物,则b为负极,a为正极,阴极电极反应式为:O2+2e-+2H2O=H2O2+2OH-,A、通入氧气在阴极还原得到H2O2,元素化合价降低,则a为正极,A错误;B、通入空气的电极发生还原反应,电极反应式为O2+2e-+2H2O=H2O2+2OH-,B错误;C、左侧氢氧根离子放电,生成水和氧气,氢氧根离子浓度降低,故左侧溶液pH降低,C正确;D、根据电极反应O2+2e-+2H2O=H2O2+2OH-,若生成17g双氧水,转移1mol电子,有1molNa+从左侧向右侧迁移,D错误;答案选C。

【题目】25℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10﹣5 | K1=4.3×10﹣7 K2=5.6×10﹣11 | 3.0×10﹣8 |
回答下列问题:
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa d.NaHCO3;pH由大到小的顺序是: ;(填编号)
(2)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是: ;
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)c(OH﹣) D.c (OH﹣)/ c(H+)
(3)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图.
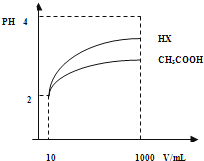
则HX的电离平衡常数 (填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是 ,
稀释后,HX溶液中水电离出来的c(H+) 醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)= .(填准确数值).