题目内容
【题目】将V1mL 1.00molL﹣1盐酸和V2mL未知浓度NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述中,正确的是( ) 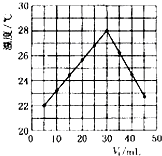
A.做实验时环境温度为22℃
B.NaOH溶液的浓度约是1.00molL﹣1
C.该实验表明化学能可以转化为热能
D.该实验表明有水生成的反应都是放热反应
【答案】C
【解析】解:A.温度为22℃时加入盐酸5mL,则不是实验温度,故A错误;
B.恰好反应时参加反应的盐酸溶液的体积是30mL,由V1+V2=50Ml可知,消耗的氢氧化钠溶液的体积为20mL,
恰好反应时氢氧化钠溶液中溶质的物质的量是n.
HCl+ | NaOH | =NaCl+H 2O |
1 | 1 | |
1.0molL﹣1×0.03L | n |
则n=1.0molL﹣1×0.03L=0.03mol,所以浓度是: ![]() =1.5mol/L,故B错误;
=1.5mol/L,故B错误;
C.发生中和反应,溶液温度升高,表明化学能可以转化为热能,故C正确;
D.只是该反应放热,其他有水生成的反应不一定,如氯化铵和氢氧化钡晶体的反应,所以D错误.
故选C.

练习册系列答案
相关题目