题目内容
【题目】检测血液中的Ca2+能够帮助判断多种疾病。某研究小组测定血液样品中Ca2+的含量(l00mL血液中含Ca2+的质量),实验步骤如下:
①准确量取5.00mL血液样品,处理后配制成50.00mL溶液;
②准确量取溶液10.00mL,加入过量(NH4)2C2O4溶液,使Ca2+完全转化成CaC2O4沉淀;
③过滤并洗净所得CaC2O4沉淀,用过量稀硫酸溶解,生成H2C2O4和CaSO4稀溶液;
④加入12.00mL0.0010mol·L-1的KMnO4溶液,使H2C2O4完全被氧化,离子方程式为:2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O;
⑤用0.0020mol·L-1 (NH4)2Fe(SO4)2溶液滴定过量的KMnO4溶液,消耗(NH4)2Fe(SO4)2溶液的体积如图所示,离子方程式为:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O
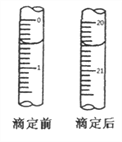
回答下列问题:
(1)已知H2C2O4属于二元弱酸,下列说法正确的是_________
A.H2C2O4 溶液中:c(H+)=c(HC2O4-)+ c(C2O42-)+ c(H2C2O4)
B.相同温度下,等物质的量浓度的(NH4)2C2O4和(NH4)2Fe(SO4)2溶液,c(NH4+)前者小于后者
C.(NH4)2C2O4 溶液中:c(NH4+)+c(NH3·H2O)=2c(HC2O4-)+2c(C2O42-)+ 2c(H2C2O4)
D.(NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(OH-)>c(H+)
(2)实验中发现向草酸溶液中逐滴加入酸性高锰酸钾溶液,溶液褪色开始时缓慢,一段时间后迅速加快,利用水浴使反应液保持恒温时也是如此,出现该现象的可能原因是_________
(3)12.00mL0.0010mol·L-1的KMnO4溶液应用_________量取(填“酸式”或“碱式”滴定管)
(4)到达滴定终点时的现象是_________
(5)若步骤⑤滴定管在使用前未用标准(NH4)2Fe(SO4)2溶液洗涤,测得血液中Ca2+的含量将_________ (填“偏高”、“偏低”或“无影响”)。
(6)计算血样中Ca2+的含量_________ g/100mL
【答案】 B C 反应生成的Mn2+催化了反应的进行,使褪色速率变快 酸式滴定管 最后一滴溶液滴下,锥形瓶中溶液颜色从浅紫色变成无色且半分钟内不变色 偏低 0.040
【解析】(1)A.根据质子守恒,H2C2O4 溶液中:c(H+)=c(HC2O4-)+ 2c(C2O42-)+ c(OH-) ,溶液显弱酸性,c(OH-)< c(H2C2O4),故A错误;B.相同温度下,等物质的量浓度的(NH4)2C2O4和(NH4)2Fe(SO4)2溶液,亚铁离子水解,抑制铵根离子的水解,c(NH4+)前者小于后者,故B正确;C.(NH4)2C2O4 溶液中存在物料守恒:c(NH4+)+c(NH3·H2O)=2c(HC2O4-)+2c(C2O42-)+ 2c(H2C2O4),故C正确;D.(NH4)2Fe(SO4)2溶液中,铵根离子浓度约为亚铁离子浓度的2倍,水解后溶液显酸性,故D错误;故选BC;
(2)实验中发现向草酸溶液中逐滴加入酸性高锰酸钾溶液,溶液褪色开始时缓慢,一段时间后迅速加快,出现该现象的原因可能是反应生成的Mn2+催化了反应的进行,使褪色速率变快,故答案为:反应生成的Mn2+催化了反应的进行,使褪色速率变快;
(3)高锰酸钾溶液具有强氧化性,能够腐蚀乳胶管,应该选用酸式滴定管盛放,故答案为:酸式;
(4)用(NH4)2Fe(SO4)2滴定过量的高锰酸钾时,腐蚀氧化还原反应,紫红色会褪去,到达滴定终点时,锥形瓶中溶液颜色从浅紫色变成无色且半分钟内不变色,故答案为:最后一滴溶液滴下,锥形瓶中溶液颜色从浅紫色变成无色且半分钟内不变色;
(5)若步骤⑤滴定管在使用前未用标准(NH4)2Fe(SO4)2溶液洗涤,导致溶液体积偏大,剩余的高锰酸钾偏多,使得测得的草酸偏多,与血液中Ca2+反应的草酸偏少,钙离子含量偏低,故答案为:偏低;
(6)KMnO4的总物质的量为:0.0010 molL-1×12×10-3L=1.2×10-5mol,(NH4)2Fe(SO4)2溶液滴定消耗的过量的KMnO4的物质的量为:0.0020 molL-1×20.00×10-3L×![]() =8.0×10-6mol,与H2C2O4反应的KMnO4的量为:1.2×10-5mol-8.0×10-6mol=4.0×10-6mol,n(H2C2O4)=4.0×10-6mol×
=8.0×10-6mol,与H2C2O4反应的KMnO4的量为:1.2×10-5mol-8.0×10-6mol=4.0×10-6mol,n(H2C2O4)=4.0×10-6mol×![]() =1.0×10-5mol,n(CaC2O4)=1.0×10-5mol,所以100mL血样中Ca2+的含量为:1.0×10-5mol×40gmol-1×
=1.0×10-5mol,n(CaC2O4)=1.0×10-5mol,所以100mL血样中Ca2+的含量为:1.0×10-5mol×40gmol-1×![]() ×
×![]() =0.04g,故答案为:0.04g。
=0.04g,故答案为:0.04g。

 名校课堂系列答案
名校课堂系列答案