题目内容
【题目】某化学小组设计实验,探究“NO2是否能与炽热的铜反应生成氧化铜和氮气”。
已知:①NO和FeSO4溶液反应:NO+FeSO4=FeSO4·NO(棕色)
②酸性KMnO4溶液吸收NO生成NO![]() 和Mn2+
和Mn2+
③Cu2O在酸性条件下能发生反应:Cu2O+2H+=Cu2++Cu+H2O
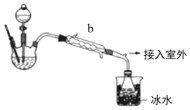
设计实验所需装置如图所示(每个装置中液态试剂均足量,且不考虑A装置挥发出的硝酸对后续装置的影响)。

回答下列问题:
(1)该实验装置较复杂,检查气密性时采用分段检查的方法,请写出A装置气密性的检验方法___。
(2)该实验装置的连接顺序为:___(填装置字母代号),C装置中盛装试剂是___(填名称)。
(3)开始实验先引发A中反应,一段时间后再点燃D处酒精灯,这样操作的目的是___。
(4)实验过程中观察到下列现象,请回答:
①B中浅绿色溶液变棕色得出实验结论是___
a.二氧化氮与铜反应的还原产物一定有NO
b.二氧化氮与铜反应的还原产物一定无NO
c.二氧化氮与铜反应的还原产物可能有NO
②E中有明显现象,该现象是___,写出发生反应的离子方程式___。
(5)当D中铜粉完全反应时冷却至室温,停止A中反应,测得反应后D中固体粉末质量为ag,
①当a=___(用含m的代数式表示)时,铜被氧化的产物全部是CuO;
②设计最简单的实验方案,验证反应后D中固体是否含有Cu2O___(试剂选任)
【答案】在分液漏斗中注入适量水,关闭止水夹,打开分液漏斗活塞,如果滴入少量水后很快停止流下,则说明装置气密性良好 ACDBE 浓硫酸 排出装置中的空气,防止氧气和铜发生反应 c 溶液紫色变浅 3![]() +4H++5NO=3Mn2++5
+4H++5NO=3Mn2++5![]() +2H2O 1.25m或
+2H2O 1.25m或![]() 取少量反应后固体溶于足量稀硫酸中,如果溶液中有红色固体,则说明固体中含有Cu2O
取少量反应后固体溶于足量稀硫酸中,如果溶液中有红色固体,则说明固体中含有Cu2O
【解析】
(2)A中浓硝酸与Cu反应生成二氧化氮,C中盛放浓硫酸干燥二氧化氮,再通入D中反应,用硫酸亚铁溶液检验有NO生成,用酸性高锰酸钾溶液吸收NO;
(3)由于装置中有空气,空气中氧气在加热条件下会与Cu反应影响实验;
(4)①NO和FeSO4溶液反应使溶液呈棕色,过量的二氧化氮在溶液中会将亚铁离子氧化为铁离子使溶液呈棕色;
②酸性KMnO4溶液吸收NO生成![]() 和Mn2+;
和Mn2+;
(5)①Cu转化为CuO,利用Cu原子守恒计算CuO的质量;
②当铜粉完全反应后,反应后的固体成分:①只有CuO、②只有Cu2O、③CuO和Cu2O,可以用酸与Cu2O反应生成Cu进行检验是否含有Cu2O。
(1) 若A装置气密性较好,则装置内外的大气压相等,检验方法:在分液漏斗中注入适量水,关闭止水夹,打开分液漏斗活塞,如果滴入少量水后很快停止流下,则说明装置气密性良好;
(2) A中浓硝酸与Cu反应生成二氧化氮,C中盛放浓硫酸干燥二氧化氮,再通入D中反应,用硫酸亚铁溶液检验有NO生成,用酸性高锰酸钾溶液吸收NO,该实验装置的连接顺序为:ACDBE;C为干燥气体装置,故选用浓硫酸来干燥,答案为:ACDBE;浓硫酸;
(3) 由于装置中有空气,空气中氧气在加热条件下会与Cu反应影响实验。开始实验,先引发A中反应,用生成的二氧化氮排出装置内空气,再点然D处酒精灯,故答案为:排出装置内空气,防止氧气和铜发生反应;
(4)①NO和FeSO4溶液反应使溶液呈棕色,过量的二氧化氮在溶液中会将亚铁离子氧化为铁离子使溶液呈棕色,B中浅绿色溶液变棕色,得出实验结论是:NO2的还原产物可能有NO,故答案为:c;
②酸性KMnO4溶液吸收NO生成NO3-和Mn2+,紫红色溶液变无色,反应离子方程式为:3![]() +4H++5NO=3Mn2++5
+4H++5NO=3Mn2++5![]() +2H2O,故答案为:溶液紫色变浅;3
+2H2O,故答案为:溶液紫色变浅;3![]() +4H++5NO=3Mn2++5
+4H++5NO=3Mn2++5![]() +2H2O;
+2H2O;
(5)①Cu转化为CuO,根据Cu原子守恒:![]() ,
,![]() ,故答案为:
,故答案为:![]() ;
;
②当铜粉完全反应后,反应后的固体成分:①只有CuO、②只有Cu2O、③CuO和Cu2O,可以用酸与Cu2O反应生成Cu进行检验是否含有Cu2O,故验证是否含有Cu2O的方法:取少量反应后固体溶于足量稀硫酸中,如果溶液中有红色固体,则说明固体中含有Cu2O。

 阅读快车系列答案
阅读快车系列答案