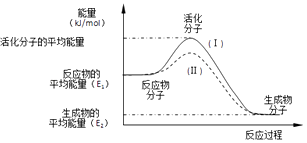
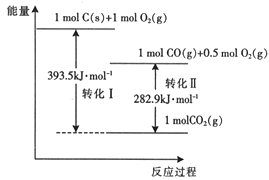
题目内容
【题目】下面是电解饱和食盐水的装置,通电一段时间后下列说法不正确的是
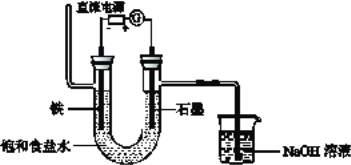
A. 阴极附近溶液的pH增大
B. 阳极产生的气体可用湿润的淀粉碘化钾试纸检验
C. 若阳极最终收集到气体4.48L,则反应中转移电子的物质的量为0.4 mol
D. 完全电解后充分混合U型管中物质,所得溶液会含有NaClO
【答案】C
【解析】根据图示分析A、电解饱和食盐水时,选用石墨棒作阳极材料时,在阳极是氯离子失电子得到氯气,而使用活泼金属铁作阴极,则阴极是水中的氢离子得电子,放出氢气,所以阴极的氢氧根离子浓度增大,故A正确;B、在阳极区域,氯离子失电子产生氯气,遇湿润的淀粉碘化钾试纸会变蓝,故B正确;C、电解过程中,氯离子在阳极失电子生成4.48L氯气,没有状态,无法计算物质的量,故C错误;D、氯化钠溶液电解后产生的氯气会和氢氧化钠溶液反应,所以溶液中会有NaClO生成,故D正确;答案:C。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】亚氯酸钠(NaClO2)是一种重要的杀菌消毒剂,同时也是对烟气进行脱硫、脱硝的吸收剂。
Ⅰ.以氯酸钠(NaClO3)为原料制备NaClO2粗品的工艺流程如下图所示:

已知:
i.纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全;
ii.NaClO2在碱性溶液中稳定存在,在酸性溶液中迅速分解;
iii.NaClO2饱和溶液在温度低于38℃时析出NaClO23H2O,等于或高于38℃时析出NaClO2晶体,高于60℃时分解成NaClO3和NaCl。
(1)试剂A应选择_________。(填字母)
a.SO2 b.浓硝酸 c.KMnO4
(2)反应②的离子方程式为_________。
(3)已知压强越大,物质的沸点越高。反应②结束后采用“减压蒸发”操作的原因是________。
(4)下列关于上述流程的说法中,合理的是_________。(填字母)
a.反应①进行过程中应持续鼓入空气
b.反应①后得到的母液中,溶质的主要成分是NaCl
c.反应②中NaOH溶液应过量
d.冷却结晶时温度选择38℃,过滤后进行温水洗涤,然后在低于60℃下进行干燥,得到粗产品NaClO2
Ⅱ.采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。
(5)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol/L。反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c /(mol/L) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式_________。
②由实验结果可知,脱硫反应速率_________(填“大于”或“小于”)脱硝反应速率。除SO2和NO在烟气中的初始浓度不同外,还可能存在的原因是_________。(答出两条即可)