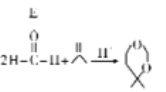题目内容
【题目】H2S以及COS(羰基硫)是化学工作者重要的研究对象。请回答下列问题:
(1)COS的分子结构与CO2相似,COS的电子式为_________。
(2)已知:①COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH1=-17KJ/mol
H2S(g)+CO(g) ΔH1=-17KJ/mol
②COS(g)+H2O(g)![]() H2S(g)+CO2(g) ΔH2=-35kJ/mol
H2S(g)+CO2(g) ΔH2=-35kJ/mol
③CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH3
H2(g)+CO2(g) ΔH3
则ΔH3=__________
(3)已知常温下,Ksp(CuS)=1.0×10-39,Ksp(PbS)=9.0×10-29。向含有浓度均为0.01mol/L的Cu2+、Pb2+废水中缓慢通入H2S,首先生成的沉淀的化学式是_______;当生成两种沉淀时,c(Pb2+)/c(Cu2+)=__________.
(4)某温度T下,在密闭容器中充入5molH2O(g)和5molCOS(g),测得混合气体中H2S体积分数(Φ)与时间(t)的关系如图所示。
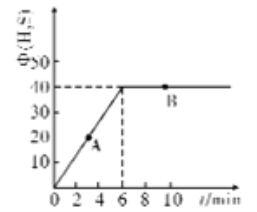
①A点COS的正反应速率_______(填“大于”“小于”或“等于”)B点COS的逆反应速率。
②在该条件下,COS的平衡转化率为________
③在该温度下,该反应的平衡常数K=__________
④在B点对应的体系中,改变下列条件,能使COS转化率增大的是______
A.再通入H2O(g) B.加压 C.降温 D.加入催化剂
【答案】 ![]() -18kJ/mol CuS 9.0×107 大于 80% 16.0 AC
-18kJ/mol CuS 9.0×107 大于 80% 16.0 AC
【解析】(1)COS的分子结构与CO2相似,所以COS的电子式为![]() 。
。
(2)①COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH1=-17KJ/mol
H2S(g)+CO(g) ΔH1=-17KJ/mol
②COS(g)+H2O(g)![]() H2S(g)+CO2(g) ΔH2=-35kJ/mol
H2S(g)+CO2(g) ΔH2=-35kJ/mol
③CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH3
H2(g)+CO2(g) ΔH3
根据已知由 ②-①=③所以ΔH3=ΔH2-ΔH1=-35kJ/mol-(-17KJ/mol)=-18 kJ/mol
(3)已知常温下,Ksp(CuS)=1.0×10-39,所以c(Cu 2-).c(S 2-)=Ksp(CuS)=1.0×10-39 所以c(S 2-) =(1.0×10-39)/ 0.01mol/L=1.0×10-37mol/L;c(Pb2+).c(S 2-)=Ksp(PbS)=9.0×10-29,c(S 2-)=(9.0×10-29)/ 0.01mol/L=9.0×10-27 mol/L,所以首先生成的沉淀的化学式CuS。在同一溶液中,当同时生成两种沉淀时,c(Pb2+)/c(Cu2+)=(9.0×10-29)mol/L /(1.0×10-37)mol/L== 9.0×107
(4)①A点COS的反应没有达到平衡,所以反应仍然向正反应方向进行,反应物的浓度大于达到平衡时B点COS的浓度,B点COS的反应达到平衡了,正反应速率等于逆反应的速率。所以A点COS的正反应速率大于B点COS的逆反应速率。
②在该条件下, 由COS(g)+H2O(g)![]() H2S(g)+CO2(g) ΔH2=-35kJ/mol
H2S(g)+CO2(g) ΔH2=-35kJ/mol
起始量(mol) 5 5 0 0
变化量(mol) X X X X
平衡量(mol) 5-X 5-X X X
由图知平衡时H2S(g)的体积分数为40![]() ,所以X/( 5-X +5-X +X +X)
,所以X/( 5-X +5-X +X +X) ![]() 100
100![]() =40
=40![]() ,X=4 mol
,X=4 mol
所以COS的平衡转化率=4/5![]() 100
100![]() =80%.答案:80%。
=80%.答案:80%。
③在该温度下,该反应的平衡常数K=[c(H2S).c(CO2)]/[c(COS).c(H2O)]=4![]() 4/1
4/1![]() 1=16.0;答案:16.0
1=16.0;答案:16.0
④A.再通入H2O(g)使平衡正反应方向进行,COS转化率增大,符合题意,故A正确;B. COS(g)+H2O(g)![]() H2S(g)+CO2(g) ΔH2=-35kJ/mol,是反应前后气体体积数相等的反应,加压,化学反应平衡不移动,反应物的转化率不会增加,故B错误;C因为此反应是放热反应,降温时,化学平衡向正反应方向移动,COS转化率增大,故C符合题意;D.催化剂只改变化学反应速率,不会影响化学平衡移动,所以不会使COS转化率增大,故D不符合题意;答案:AC。
H2S(g)+CO2(g) ΔH2=-35kJ/mol,是反应前后气体体积数相等的反应,加压,化学反应平衡不移动,反应物的转化率不会增加,故B错误;C因为此反应是放热反应,降温时,化学平衡向正反应方向移动,COS转化率增大,故C符合题意;D.催化剂只改变化学反应速率,不会影响化学平衡移动,所以不会使COS转化率增大,故D不符合题意;答案:AC。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案