题目内容
6.以下关于第IA族元素和第ⅦA族元素的有关叙述正确的是( )| A. | 从上到下,第IA族元素单质的密度逐渐增大 | |
| B. | 从上到下,第IA族元素单质的熔点逐渐降低 | |
| C. | 从上到下,第ⅦA族元素其氢化物的稳定性逐渐增强 | |
| D. | 从上到下,第ⅦA族元素其氢化物的沸点逐渐升高 |
分析 A、从上到下,第IA族元素单质的密度总体逐渐增大,但钾的密度比钠小;
B、第IA族元素,原子半径逐渐增大、金属性逐渐增强,但其单质的熔沸点先增大后减小;
C、第VIIA族元素从上到下,非金属性在减弱,则其氢化物的稳定性逐渐减弱;
D、VIIA元素,非金属单质的熔沸点随核电荷数的增加而升高,因为单质属于分子晶体,熔沸点与分子间作用力有关,分子构型相同,相对分子量越大,分子间作用力越大,则熔沸点越高.
解答 解:A、第IA族元素从上到下,钾的密度比钠小,故A错误;
B、IA元素除氢外,金属单质的熔点随核电荷数的增加而降低,因为单质属于金属晶体,熔沸点与金属键能有关,原子半径越来越大,金属键越来越弱,所以熔沸点逐渐降低,故B正确;
C、第VIIA族元素从上到下,非金属性在减弱,则其氢化物的稳定性逐渐减弱,故C错误;
D、氟化氢分子与分子之间存在氢键,所以沸点最大,故D错误;
故选B.
点评 本题考查元素周期律的相关知识,学生要注意特例如第IA族元素钾的密度比钠小,氟化氢分子与分子之间存在氢键等,解这类题目就得心应手了.

练习册系列答案
相关题目
16.某有机物的结构简式为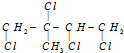 ,它是由某烃和Cl2充分加成所得到的产物,则原有机物一定是( )
,它是由某烃和Cl2充分加成所得到的产物,则原有机物一定是( )
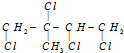 ,它是由某烃和Cl2充分加成所得到的产物,则原有机物一定是( )
,它是由某烃和Cl2充分加成所得到的产物,则原有机物一定是( )| A. | 2-丁炔 | B. | 2-甲基-1,3-丁二烯 | ||
| C. | 1,3-丁二烯 | D. | 1,4-二氯-2-甲基-2-丁烯 |
14.X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z的最外层电子数是内层电子总数的三倍.有关下列叙述正确的是( )
| A. | X、Y、Z三种元素可形成化合物X3YZ4 | |
| B. | X、Y两元素形成的化合物只可能为离子化合物 | |
| C. | Y、Z两元素形成的化合物均会对空气造成污染 | |
| D. | 稳定性:Y的氢化物大于Z的氢化物 |
11.下列除去杂质的方法正确的是:( )
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏;
③除去苯中混有的少量苯酚:加入浓溴水后过滤取滤液;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏;
③除去苯中混有的少量苯酚:加入浓溴水后过滤取滤液;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
18.下列叙述中,不正确的是( )
| A. | 共价化合物中不可能含有离子键 | |
| B. | 硫酸分子中有H+和SO42-两种离子 | |
| C. | 某元素原子的最外层只有一个电子,它跟卤素可能形成离子键,也可能形成共价键 | |
| D. | 离子键和共价键的实质都是电性的相互作用 |
15.下列各组均有两种有机物,若分别取相同的物质的量,在足量的氧气中完全燃烧,两种有机物耗氧量不相同的是( )
| A. | 乙烯和乙醇 | B. | 苯酚和苯甲醇 | C. | 甲烷和乙酸 | D. | 乙炔和乙醛 |
16.由下列实验事实得出的结论正确的是( )
| 实验事实 | 结论 | |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | 将SO2通入Ba(NO3)2溶液,有白色沉淀生成 | BaSO3难溶于硝酸 |
| C | Na2SiO3溶液中通CO2气体出现浑浊 | 酸性:H2SiO3<H2CO3 |
| D | 浓硫酸使蔗糖变黑 | 浓硫酸有脱水性 |
| A. | A | B. | B | C. | C | D. | D |
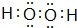 .固体化合物E2D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的离子方程式为Na2O2+2H2O+S2-=S+4Na++4OH-.
.固体化合物E2D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的离子方程式为Na2O2+2H2O+S2-=S+4Na++4OH-.