题目内容
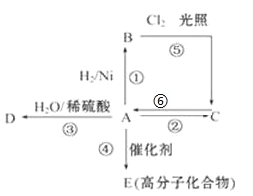
【题目】某学习小组在实验室通过6NaClO3 + CH3OH + 3H2SO4 = 6ClO2 + 5H2O + 3Na2SO4 + CO2制备ClO2,并将其转化为便于运输和储存的NaClO2固体,实验装置如图所示。(已知ClO2沸点为10℃,浓度较高时易发生爆炸)下列说法正确的是
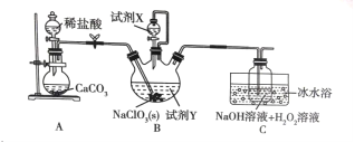
A.试剂X是甲醇
B.B中开始反应后立即停止通二氧化碳
C.此实验可以不用冰水浴
D.C中发生的反应方程式为:2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2
【答案】D
【解析】
A. 根据装置图和方程式6NaClO3 + CH3OH + 3H2SO4 = 6ClO2 + 5H2O + 3Na2SO4 + CO2可知X是硫酸,A项错误;
B. ClO2浓度较高时易发生爆炸,所以反应中不能停止通二氧化碳,B项错误;
C. ClO2沸点为10℃,冰水浴可以使其液化,使反应更加充分,C项错误;
D. C中反应将ClO2转化为NaClO2,反应方程式为:2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2,D项正确;
答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某化学实验小组用酸性KMnO4溶液与草酸(H2C2O4)溶液反应,研究外界条件对反应速率的影响,实验操作及现象如下:
编号 | 实验操作 | 实验现象 |
I | 向一支试管中先加入1 mL 0.01 mol/L酸性KMnO4溶液,再加入1滴3 mol/L硫酸和9滴蒸馏水,最后加入1 mL 0.1 mol/L草酸溶液 | 前10 min内溶液紫色无明显变化,后颜色逐渐变浅,30 min后几乎变为无色 |
II | 向另一支试管中先加入1 mL 0.01 mol/L酸性KMnO4溶液,再加入10滴3 mol/L硫酸,最后加入1 mL 0.1 mol/L草酸溶液 | 80 s内溶液紫色无明显变化,后颜色迅速变浅,约150 s后几乎变为无色 |
(1)写出高锰酸钾与草酸反应的离子方程式:______________________________。
(2)由实验I、II可得出的结论是_______________________________。
(3)关于实验II中80 s后溶液颜色迅速变浅的原因,该小组提出猜想:反应中生成的Mn2+对该反应有催化作用。利用提供的试剂设计实验III,验证猜想。提供的试剂:0.01 mol/L酸性 KMnO4溶液,0.1 mol/L草酸溶液,3 mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水补全实验III的操作:向试管中先加入1 mL 0.01 mol/L酸性KMnO4溶液,_______,最后加入1 mL 0.1 mol/L草酸溶液。
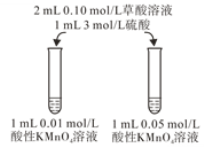
(4)该小组拟采用如图所示的实验方案继续探究KMnO4溶液浓度对反应速率的影响。你认为他们的实验方案______(填“合理”或“不合理”),理由是___________。
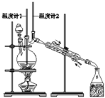
【题目】已知:CH3CH2CH2CH2OH![]() CH3CH2CH2CHO;利用如图装置用正丁醇合成正丁醛相关数据如表:
CH3CH2CH2CHO;利用如图装置用正丁醇合成正丁醛相关数据如表:
物质 | 沸点/℃ | 密度 / gcm-3 | 水中溶解性 |
|
正丁醇 | 117.2 | 0.8109 | 微溶 | |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是
A.为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B.当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物
C.反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D.向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇