题目内容
【题目】对于可逆反应:mA(g)+nB(g) ![]() pC(g)+qD(g)(m、n、p、q均为化学计量数),根据图示曲线回答:
pC(g)+qD(g)(m、n、p、q均为化学计量数),根据图示曲线回答:
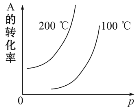
(1)正反应是___热反应。
(2)m+n___p+q(填“>”“<”或“=”)。
(3)若将纵坐标A的转化率换成A在平衡混合物中的质量分数,则逆反应是____ 热反应,m+n___p+q(填“>”“<”或“=”)。
【答案】 吸 > 吸 <
【解析】
(1)根据图示,升高温度,A的转化率增大,平衡正向移动;(2)根据图示,增大压强,A的转化率增大,平衡正向移动。(3)若将纵坐标A的转化率换成A在平衡混合物中的质量分数,升高温度,A在平衡混合物中的质量分数增大,所以平衡逆向移动;增大压强,A在平衡混合物中的质量分数增大,所以平衡逆向移动。
(1)根据图示,升高温度,A的转化率增大,平衡正向移动,所以正反应是吸热反应;(2)根据图示,增大压强,A的转化率增大,平衡正向移动,所以m+n>p+q。(3)若将纵坐标A的转化率换成A在平衡混合物中的质量分数,升高温度,A在平衡混合物中的质量分数增大,平衡逆向移动,所以逆反应是吸热反应;增大压强,A在平衡混合物中的质量分数增大,平衡逆向移动,所以m+n<p+q。

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目