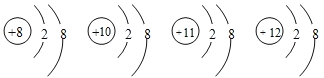题目内容
【题目】含氯的物质与人们的生活密切相关。已知氯元素常见的化合价有-1、0、+1、+3、+5、+7六种,其不同价态的物质间可相互转化。回答下列问题:
(1)氯原子的原子结构示意图___;氯离子的电子式___。
(2)氯气能使湿润的有色布条褪色,起到漂白作用的物质是____(写名称),漂粉精的主要有效成分是___(写化学式)。
(3)实验室制取氯化氢的化学方程式____。
(4)工业上将含有氯气的尾气通过___进行处理,在处理时发生的反应中氯气作为____。
a.氧化剂 b.还原剂 c.既是氧化剂又是还原剂 d.既不是氧化剂又不是还原剂
(5)写出氯气的两种用途____、____。
【答案】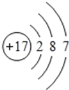
![]() 次氯酸 Ca(ClO)2 NaCl+H2SO4
次氯酸 Ca(ClO)2 NaCl+H2SO4![]() NaHSO4+HCl↑ NaOH溶液 c 制盐酸 漂白粉
NaHSO4+HCl↑ NaOH溶液 c 制盐酸 漂白粉
【解析】
(1)氯原子是17号元素,核外电子分为三个电子层,第一层2个电子,第二层8个电子,第三层7个电子,原子结构示意图为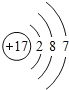 ;氯离子为阴离子,原子周围有8个电子,氯离子的电子式为:
;氯离子为阴离子,原子周围有8个电子,氯离子的电子式为:![]() ;
;
故答案为: ;
;![]() ;
;
(2)氯气与水反应生成HClO,HClO有漂白性,则氯气能使湿润的有色布条褪色,起到漂白作用的物质是次氯酸;漂粉精的主要有效成分是次氯酸钙,其化学式为Ca(ClO)2;
故答案为:次氯酸;Ca(ClO)2;
(3)实验室制备氯化氢气体利用原料氯化钠和浓硫酸加热反应生成氯化氢,微热时生成硫酸氢钠和氯化氢,反应的化学方程式为:NaCl+H2SO4![]() NaHSO4+HCl↑,
NaHSO4+HCl↑,
故答案为:NaCl+H2SO4![]() NaHSO4+HCl↑;
NaHSO4+HCl↑;
(4)氯气是有毒气体,能与氢氧化钠溶液反应,氯气用氢氧化钠溶液吸收;氯气与NaOH反应时,Cl元素的化合价既升高又降低,所以氯气既是氧化剂又是还原剂;
故答案为:NaOH溶液;c;
(5)氯气是一种有着广泛用途的重要化工原料,可用于制盐酸、漂白粉、有机溶剂与多种农药,
故答案为:制盐酸;漂白粉。