题目内容
【题目】Ⅰ、化学实验是化学学习的重要内容,根据你掌握的知识,完成下面内容。实验室需要配制0.1mol·L-1 NaOH溶液230mL,请回答下列问题:
(1)用天平称取______ g NaOH。配制过程中所需玻璃仪器除了胶头滴管和烧杯,还有_____、______ 。
(2)溶解NaOH后的溶液需冷却到室温后方能转移。若趁热转移会使溶液的浓度 _____(填“偏大”、或“偏小”,下同)
(3)有人认为,用这种方法只能配制0.1mol· L-1 的NaOH溶液,而无法得到0.1000mol· L-1 的NaOH溶液,你觉得他的理由是____________ 。
Ⅱ.氯气是一种重要的化工原料,自来水消毒、农药生产、药物合成都需要它。

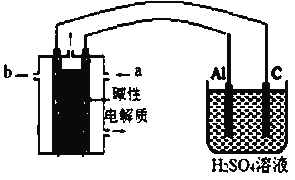
(1)工业上通常采用电解法制氯气,请观察图1后回答下列问题:
通电后,b侧产生的气体用湿润的淀粉碘化钾试纸检验,现象是变蓝。化学方程式_____
(2)某学生设计如图2所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),回答下列问题:
①在A装置中制取氯气,请写出反应的化学方程式 ____________。
②漂白粉在U形管中产生,其化学方程式是 ____________。
③装置C的作用是__________。
(3)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应发生,可采取的措施是_______。
②试判断另一个副反应(用化学方程式表示)________,为避免此副反应的发生,可以在A与B之间连接一个装有_______ 的洗气瓶。
【答案】1.0g 250mL容量瓶和玻璃棒 偏大 偏大 由于NaOH固体极易溶解潮解,无法精确称取1.00gNaOH固体 Cl2 +2KI = I2 +2KCl MnO2+ 4HCl(浓)![]() MnCl2 + Cl2↑ +2H2O 2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2+ 2H2O 吸收未反应完的氯气,防止污染空气 冷却B装置 2HCl +Ca(OH)2 =CaCl2 +2H2O 饱和氯化钠溶液
MnCl2 + Cl2↑ +2H2O 2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2+ 2H2O 吸收未反应完的氯气,防止污染空气 冷却B装置 2HCl +Ca(OH)2 =CaCl2 +2H2O 饱和氯化钠溶液
【解析】
Ⅰ、(1)需用250mL容量瓶配制该溶液,根据m=cVM计算氢氧化钠的质量;根据配制溶液的步骤选择仪器;
(2)根据![]() 分析误差;
分析误差;
(3)要精确配制0.1000mol· L-1 的NaOH溶液,需用准确称取1.00gNaOH固体;
Ⅱ. (1)氯气能使湿润的淀粉碘化钾试纸变蓝;
(2)①在A装置中二氧化锰与浓盐酸反应生成氯气;
②U形管中,氯气和氢氧化钙反应生成氯化钙、次氯酸钙、水;
③氢氧化钠溶液与氯气反应生成氯化钠、次氯酸钠;
(3)①根据信息 “温度较高时氯气与消石灰反应生成Ca(ClO3)2”分析;
②氯气中含有杂质氯化氢,氢氧化钙与氯化氢反应;
Ⅰ、(1)需用250mL容量瓶配制该溶液, m(NaOH)= 0.1mol·L-1 ×0.25L×40g/mol=1.0g;配制过程中用玻璃棒搅拌、引流,用250mL容量瓶定容,所以配制过程中所需玻璃仪器除了胶头滴管和烧杯,还有250mL容量瓶和玻璃棒。
(2)若趁热转移,溶液体积偏小,会使溶液的浓度偏大;
(3). 用托盘天平无法精确称取1.00gNaOH固体,所以无法得到0.1000mol· L-1 的NaOH溶液;
Ⅱ.(1)氯气能置换出碘化钾中的碘单质,使试纸变蓝,反应的化学方程式是Cl2 +2KI = I2 +2KCl;
(2)①在A装置中二氧化锰与浓盐酸反应生成氯气,反应方程式是MnO2+ 4HCl(浓)![]() MnCl2 + Cl2↑ +2H2O;
MnCl2 + Cl2↑ +2H2O;
②U形管中,氯气和氢氧化钙反应生成氯化钙、次氯酸钙、水,反应的化学方程式是2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2+ 2H2O;
③氢氧化钠吸收未反应完的氯气,防止污染空气;
(3)①温度较高时氯气与消石灰反应生成Ca(ClO3)2,所以冷却B装置可以避免此副反应发生;
②氯气中含有杂质氯化氢,氢氧化钙与氯化氢反应,反应方程式是2HCl +Ca(OH)2 =CaCl2 +2H2O;在A与B之间连接一个装有饱和食盐水的洗气瓶除去氯化氢,可避免此副反应的发生。

 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案【题目】某小组同学探究物质的溶解度大小与沉淀转化方向之间的关系。已知:
物质 | BaSO4 | BaCO3 | AgI | AgCl | |
溶解度/g(20℃) | 2.4×10-4 | 1.4×10-3 | 3.0×10-7 | 1.5×10-4 |
(1)探究BaCO3和BaSO4之间的转化
实验操作:
试剂A | 试剂B | 试剂C | 加入盐酸后的现象 | |
实验Ⅰ | BaCl2 | Na2CO3 | Na2SO4 | …… |
实验Ⅱ | Na2SO4 | Na2CO3 | 有少量气泡产生,沉淀部分溶解 |
① 实验Ⅰ说明BaCO3全部转化为BaSO4,依据的现象是加入盐酸后,______。
② 实验Ⅱ中加入稀盐酸后发生反应的离子方程式是______。
③ 实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因:______。
(2)探究AgCl和AgI之间的转化
实验Ⅲ:
实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。
装置 | 步骤 | 电压表读数 | |
| ⅰ.如图连接装置并加入试剂,闭合K | a | |
ⅱ.向B中滴入AgNO3(aq),至沉淀完全 | b | ||
ⅲ.再向B中投入一定量NaCl (s) | c | ||
ⅳ.重复ⅰ,再向B中加入与ⅲ等量NaCl(s) | a |
注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
① 实验Ⅲ证明了AgCl转化为AgI,甲溶液可以是______(填序号)。
a. AgNO3溶液 b. NaCl溶液 c. KI溶液
② 实验Ⅳ的步骤ⅰ中,B中石墨上的电极反应式是______。
③ 结合信息,解释实验Ⅳ中b<a的原因:______。
④ 实验Ⅳ的现象能说明AgI转化为AgCl,理由是______。
(3)综合实验Ⅰ~Ⅳ,可得出结论: ______。