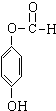
题目内容
11.下列关于实验的描述错误的是( )| A. | 将硫酸铜溶液加热蒸发、浓缩、冷却结晶,可以制备硫酸铜晶体 | |
| B. | 测定等浓度NaClO溶液和Na2SO4溶液的pH,比较Cl、S元素的非金属性强弱 | |
| C. | 萃取法除去NaBr溶液中的少量NaI,需要用烧杯、玻璃棒、胶头滴管、分液漏斗 | |
| D. | 检验Na2SO3固体是否被部分氧化:取少量固体溶于水,滴加过量稀盐酸,观察是否产生气泡,再滴加BaCl2溶液,观察是否产生白色沉淀 |
分析 A.硫酸铜溶液水解生成的硫酸难挥发,结晶法可得到晶体;
B.测定等浓度NaClO溶液和Na2SO4溶液的pH,可知硫酸酸性大于HClO的酸性,但HClO不是最高价氧化物的含氧酸;
C.除去NaBr溶液中的少量NaI,先加溴水再萃取;
D.Na2SO3固体部分氧化生成硫酸钠,检验硫酸钠应先加盐酸排除亚硫酸钠的干扰.
解答 解:A.硫酸铜溶液水解生成的硫酸难挥发,则溶液加热蒸发、浓缩、冷却结晶,可以制备硫酸铜晶体,故A正确;
B.测定等浓度NaClO溶液和Na2SO4溶液的pH,可知硫酸酸性大于HClO的酸性,但HClO不是最高价氧化物的含氧酸,则不能利用此酸性比较非金属性,故B错误;
C.除去NaBr溶液中的少量NaI,先加溴水再萃取,萃取需要的仪器为烧杯、玻璃棒、胶头滴管、分液漏斗,故C正确;
D.Na2SO3固体部分氧化生成硫酸钠,检验硫酸钠应先加盐酸排除亚硫酸钠的干扰,则取少量固体溶于水,滴加过量稀盐酸,观察是否产生气泡,再滴加BaCl2溶液,观察是否产生白色沉淀,若生成白色沉淀,则部分氧化,故D正确.
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及酸性和非金属性的比较、氧化还原反应及离子检验、混合物分离提纯及晶体制备等,把握物质的性质、实验技能为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.以色列科学家达尼埃尔•谢赫特曼因发现“准晶体”独获2011年诺贝尔化学奖.某准晶体W由一定比例的铁、铜、铝组成,取两小块该准晶体:一块投入烧杯①中,注入浓氢氧化钠溶液浸没固体;另一块投入烧杯②中,注入稀硫酸浸没固体.下列分析合理的是( )
| A. | 烧杯①中,若构成微型电池,负极反应式为2Al-6e-=2Al3+,正极反应式为 6H++6e-=3H2↑ | |
| B. | 烧杯①中,若将电解质溶液换成浓硝酸,构成微型电池时铝为负极,铜为正极 | |
| C. | 烧杯②中,若铁、铜构成微型电池,则铁为负极;若铝、铁构成微型电池,则铁为正极 | |
| D. | 烧杯②中,固体最终完全溶解,溶液呈蓝色.向溶液中滴加KSCN溶液,溶液不变色 |
2.下列说法或解释不正确的是( )
| A. | 物质的量浓度均为1 mol•L-1的NaCl和MgCl2中:c(Cl-)=3c(Na+) | |
| B. | 等物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3•H2O,c(NH4+)由大到小的顺序是①>②>③>④ | |
| C. | 室温下,向0.01 mol•L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | 向0.2 mol•L-1 NaHCO3溶液中加入等体积0.1 mol•L-1 NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
19.下列关于反应热的说法正确的是( )
| A. | 当△H<0时,表示该反应为吸热反应 | |
| B. | 已知C(s)+O2(g)=CO(g)△H=-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol | |
| C. | 反应热的大小与反应物所具有的能量和生成物所具有的能量无关 | |
| D. | 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关 |
3.化学实验中,人的五官起着非常重要的作用,五官的使用符合实验要求的是( )
| A. |  鼻子闻 | B. |  嘴巴吹 | C. |  耳朵听 | D. |  眼睛看 |
20.标准状况下,NO2和O2按4:1的体积比混合充满一个大试管,把大使管倒立于水中,水面逐渐上升,最后试管中溶液的物质的量浓度(不考虑试管中溶液扩散)为( )
| A. | 0.8mol•L-1 | B. | 0.72mol•L-1 | C. | 0.1mol•L-1 | D. | 0.036mol•L-1 |
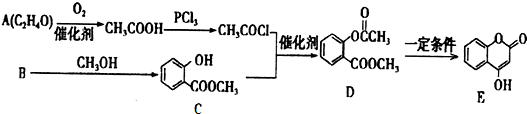
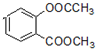 +3NaOH→CH3COONa+CH3OH+
+3NaOH→CH3COONa+CH3OH+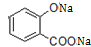 +H2O.
+H2O.