题目内容
12.0.2mol有机物与0.5mol O2恰好完全燃烧后的产物为CO2和H2O(g).产物经过浓硫酸后,浓硫酸的质量增加10.8g;再通过碱石灰剩余气体被完全吸收,碱石灰质量增加17.6g.(1)燃烧后产物的物质的量分别为CO20.4mol、H2O(g)0.6mol.
(2)推断该有机物的分子式为C2H6O2.
(3)若0.2mol该有机物恰好与9.2g金属钠完全反应,其核磁共振氢谱显示只有两种不同环境的H,试确定该有机物的结构简式为HOCH2CH2OH.
分析 (1)浓硫酸具有吸水性,产物质量减轻10.8g,说明反应产物中含水10.8g,碱石灰增重的为二氧化碳的质量,根据n=$\frac{m}{M}$分别计算出水和二氧化碳的物质的量;
(2)根据元素守恒计算有机物中含有C、H、O的物质的量,进而求得化学式;
(3)结合分子式、消耗钠的物质的量判断分子中官能团,然后写出其结构简式.
解答 解:(1)有机物燃烧生成水10.8g,物质的量为:$\frac{10.8g}{18g/mol}$=0.6mol,
碱石灰增重的质量为二氧化碳的质量,则二氧化碳的物质的量为:$\frac{17.6g}{44g/mol}$=0.4mol,
故答案为:0.4;0.6;
(2)根据氢元素守恒可知,该有机物含有氢原子数目为:$\frac{0.6mol×2}{0.2mol}$=6,含有碳原子的数目为:$\frac{0.4mol}{0.2mol}$=2,
根据氧元素守恒可知,该有机物含有氧原子的数目为:$\frac{0.6mol+0.4mol×2-0.5mol×2}{0.2mol}$=2,
所以有机物的分子式为:C2H6O2,
故答案为:C2H6O2;
(3)若0.2mol该有机物与9.2金属钠完全反应,钠的物质的量为:$\frac{9.2g}{23g/mol}$=0.4mol,说明该有机物分子中含有羟基或羧基,
1mol该有机物完全反应消耗钠的物质的量为2mol,结合分子式C2H6O2可知,该有机物分子中含有2个羟基,
所以该有机物的结构简式为:HOCH2CH2OH,
故答案为:HOCH2CH2OH.
点评 本题考查有机物分子式、结构简式的确定,题目难度中等,注意掌握利用所含元素原子守恒判断有机物的分子式的方法,明确常见有机物结构与性质.

练习册系列答案
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
2.氮及氮的化合物在生产生活中有着重要的用途,NH3、HNO3等是重要化工产品.
(1)合成氨的原料气N2和H2通常是以焦炭、水和空气为原料来制取的.其主要反应是:①2C+O2→2CO ②C+H2O(g)→CO+H2 ③CO+H2O(g)→CO2+H2
某次生产中将焦炭、H2O(g)和空气(设空气中N2和O2的体积比为4:1,下同)混合反应,所得气体产物经分析,组成如下表:表中x=44m3,实际消耗了30 kg焦炭.
(2)汽车尾气会排放氮的氧化物污染环境.已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0
若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡.测得NO为8×10-4mol.计算该温度下的平衡常数K=$\frac{[NO]^{2}}{[{N}_{2}]•[{O}_{2}]}$=4×10-6(写出表达式,并计算出结果);汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移.
(3)SO2和氮的氧化物都是空气中的有害气体,已知:
2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=-41.8kJ•mol-1.
(4)25℃时,电离平衡常数:
回答下列问题:
a.常温下,将0.1mol/L的次氯酸溶液与0.1mol/L的碳酸钠溶液等体积混合,所得溶液中各种离子浓度关系正确的是BCE
A.c(Na+)>c(ClO-)>c(HCO3-)>c(OH-)
B.c(Na+)>c(HCO3-)>c(ClO-)>c(H+)
C.c(Na+)═c(HClO)+c(ClO-)+c(HCO3-)+c(H2CO3)+c(CO32-)
D.c(Na+)+c(H+)═c(ClO-)+c(HCO3-)+2c(CO32-)
E.c(HClO)+c(H+)+c(H2CO3)═c(OH-)+c(CO32-)
b.0.1mol/L的酒石酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC4H4O6-)+2c(C4H4O62-)=(0.05+10-6-10-8)mol/L.(列出计算式)
(1)合成氨的原料气N2和H2通常是以焦炭、水和空气为原料来制取的.其主要反应是:①2C+O2→2CO ②C+H2O(g)→CO+H2 ③CO+H2O(g)→CO2+H2
某次生产中将焦炭、H2O(g)和空气(设空气中N2和O2的体积比为4:1,下同)混合反应,所得气体产物经分析,组成如下表:表中x=44m3,实际消耗了30 kg焦炭.
| 气体 | CO | N2 | CO2 | H2 | O2 |
| 体积(m3)(标准状况) | x | 20 | 12 | 60 | 1.0 |
若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡.测得NO为8×10-4mol.计算该温度下的平衡常数K=$\frac{[NO]^{2}}{[{N}_{2}]•[{O}_{2}]}$=4×10-6(写出表达式,并计算出结果);汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移.
(3)SO2和氮的氧化物都是空气中的有害气体,已知:
2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=-41.8kJ•mol-1.
(4)25℃时,电离平衡常数:
| 化学式 | H2CO3 | HClO | H2C4H4O6(酒石酸) |
| 电离平衡常数 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=9.1×10-4 K2=4.3×10-5 |
a.常温下,将0.1mol/L的次氯酸溶液与0.1mol/L的碳酸钠溶液等体积混合,所得溶液中各种离子浓度关系正确的是BCE
A.c(Na+)>c(ClO-)>c(HCO3-)>c(OH-)
B.c(Na+)>c(HCO3-)>c(ClO-)>c(H+)
C.c(Na+)═c(HClO)+c(ClO-)+c(HCO3-)+c(H2CO3)+c(CO32-)
D.c(Na+)+c(H+)═c(ClO-)+c(HCO3-)+2c(CO32-)
E.c(HClO)+c(H+)+c(H2CO3)═c(OH-)+c(CO32-)
b.0.1mol/L的酒石酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC4H4O6-)+2c(C4H4O62-)=(0.05+10-6-10-8)mol/L.(列出计算式)
3.下列结论错误的是( )
①微粒半径:r(K+)>r(Al3+)>r(S2-)>r(Cl-)
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
①微粒半径:r(K+)>r(Al3+)>r(S2-)>r(Cl-)
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
| A. | ① | B. | ①③ | C. | ②③④⑤⑥⑦ | D. | ①③⑤ |
20.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 1 mol聚乙烯含有的原子数目为6NA | |
| B. | 标准状况下,11.2L CHCl3中所含有的原子总数为2.5NA | |
| C. | 一定条件下,2.6 g乙炔、苯的气态混合物中所含碳原子数为0.2NA | |
| D. | 1 mol甲基与1mol羟基所含电子数均为10 NA个 |
7.我们能在昏暗的光线下看见物体,离不开视网膜中一种叫“视黄醛”(见甲)的有机化合物,而与视黄醛相似结构的维生素A(见乙)常作为保健药物.则下列有关叙述正确的是( )


| A. | 视黄醛的分子式为C21H26O | |
| B. | 维生素A分子结构中含有苯环、碳碳双键和羟基 | |
| C. | 视黄醛是维生素A的氧化产物 | |
| D. | 1 mol甲和1 mol乙在一定条件下均最多能与6 mol H2发生反应 |
4.无色的气体甲,可能含NO、O2、NH3、N2中的几种,将100mL甲气体经过如图所示实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成可能为( )
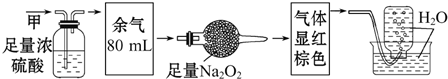

| A. | NH3、NO2、N2 | B. | NH3、NO、CO2 | C. | NH3、NO2、CO2 | D. | NO、CO2、N2 |
1.以色列科学家达尼埃尔•谢赫特曼因发现“准晶体”独获2011年诺贝尔化学奖.某准晶体W由一定比例的铁、铜、铝组成,取两小块该准晶体:一块投入烧杯①中,注入浓氢氧化钠溶液浸没固体;另一块投入烧杯②中,注入稀硫酸浸没固体.下列分析合理的是( )
| A. | 烧杯①中,若构成微型电池,负极反应式为2Al-6e-=2Al3+,正极反应式为 6H++6e-=3H2↑ | |
| B. | 烧杯①中,若将电解质溶液换成浓硝酸,构成微型电池时铝为负极,铜为正极 | |
| C. | 烧杯②中,若铁、铜构成微型电池,则铁为负极;若铝、铁构成微型电池,则铁为正极 | |
| D. | 烧杯②中,固体最终完全溶解,溶液呈蓝色.向溶液中滴加KSCN溶液,溶液不变色 |
2.下列说法或解释不正确的是( )
| A. | 物质的量浓度均为1 mol•L-1的NaCl和MgCl2中:c(Cl-)=3c(Na+) | |
| B. | 等物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3•H2O,c(NH4+)由大到小的顺序是①>②>③>④ | |
| C. | 室温下,向0.01 mol•L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | 向0.2 mol•L-1 NaHCO3溶液中加入等体积0.1 mol•L-1 NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
 (1)明矾可用于净水,用离子方程式解释其原因Al3++3H2O?Al(OH)3(胶体)+3H+.把FeCl3溶液蒸干、灼烧、最后得到的主要固体产物是Fe2O3.
(1)明矾可用于净水,用离子方程式解释其原因Al3++3H2O?Al(OH)3(胶体)+3H+.把FeCl3溶液蒸干、灼烧、最后得到的主要固体产物是Fe2O3.